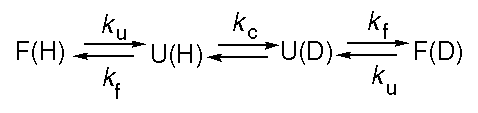Felgombolyodási kinetikák, mechanizmusok
1. Alapkísérletek
2. Többállapotú viselkedés
3. Hidrogénkicserélődéses módszerek
4. Példák a felgombolyodás részletes jellemzésére
Alapkísérletek
- Egyensúlyi felgombolyodásvizsgálatok
- Egyensúly létrehozása denaturálószer jelenlétében
- Egyensúlyi hődenaturáció
- Kinetikus felgombolyodásvizsgálatok
- Fel- vagy legombolyodás indítása denaturálószer jelenlétében (gyors
keverés)
- A folyamat nyomonkövetése ált. optikai úton
- Vannak-e köztes állapotok (köztitermékek)?
- Egyensúlyi köztitermékek: annyira stabilak, hogy egyensúlyi
állapotban észlelhetőek
- Kinetikus köztitermékek: metastabilak, csak kinetikus mérés során
észlelhetőek
- Ha nincs észlelhető arányban felhalmozódó köztitermék,
akkor kétállapotú viselkedésről beszélünk.
Egyensúlyi kísérlet
Denaturálószerrel (D, urea vagy guanidin-hidroklorid, GdnHCl)
végezve:
- Fehérjemintákat különböző koncentrációjú (D)
denaturálószer-oldatokban állni hagyunk
- A D koncentráció 0-tól töményig terjed (8M urea v. 6M GdnHCl)
- megvárjuk a fel- és legombolyodás egyensúlyának beálltát (órák)
- megmérünk egy optikai jellemzőt, mely érzékeny a konformációra
(cirkuláris dikroizmus, fluoreszcencia)
Kétállapotú viselkedés esetén:
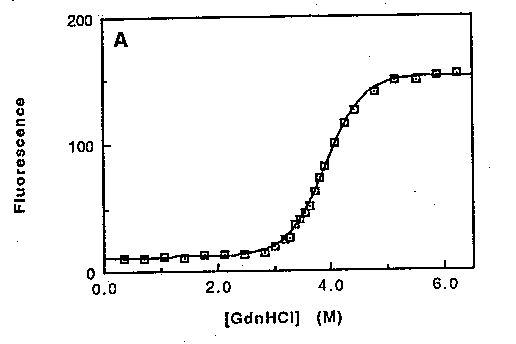
szigmoid görbe (S alakú).
Bármely D-nél a legombolyodás egyensúlyi állandója:
KU(D) = [U]/[F] = (IF -
I(D))/(I(D) - IU)
ahol I(D), ill. IF és
IU a mért optikai jellemző D
denaturálószer-koncentráció mellett, ill. natív (folded, 0
denaturálószer-koncentráció) és denaturált (unfolded, maximális
denaturálószer-koncentráció) állapotban.
KU-ból a legombolyodás szabadentalpiája:
deltaGU(D) = - RT ln
KU(D)
Kétállapotú rendszernél ez lineáris:
deltaGU(D) =
deltaGU,víz -
mUD
ahol deltaGU,víz a vízben (D=0) érvényes
legombolyodási szabadentalpia,
mU meredekség: konstans, arányos a legombolyodáskor hozzáférhetővé
váló felszín nagyságával.
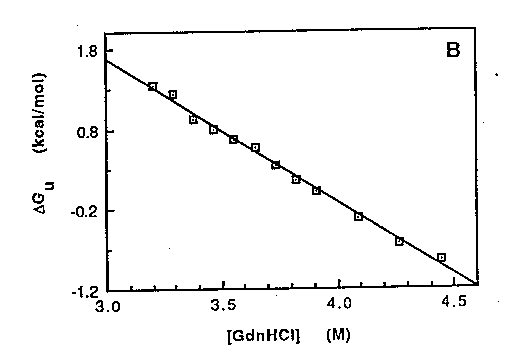
Az egyenest a D=0 denaturálószer-koncentrációra extrapolálva
megkapjuk a deltaGU,víz értéket, ami a fehérje
stabilitásának mértéke vízben.
Hődenaturáció útján
- A fehérjeoldatot lassan melegítjük, időt hagyva az egyensúly
mindenkori beállására
- Optikai jellemzőt vagy hőelnyelést mérünk
- Optikai jellemzőnél: kiértékelés hasonló, mint a denaturálószernél;
Van't Hoff-plotok
- Hőelnyelés mérésénél (kalorimetria): minden termodinamikai mennyiség
számítható.
- Tipikus hőkapacitásgörbe:
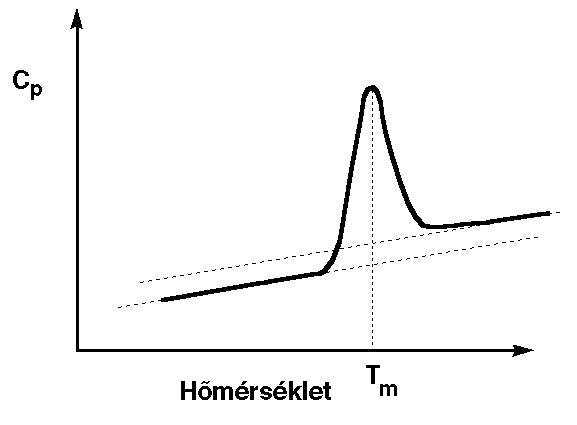
- kalorimetrikus entalpia: görbe alatti területből
- Van't Hoff-entalpia: a görbéből, kétállapotú átmenetet
feltételezve
Az egyensúlyi legombolyodás kétállapotúságának feltételei
- A denaturálószeres mérési adatoknak illeszkedniük kell a kétállapotú
átmenetre jellemző görbére (szigmoid, ill deltaG-ben egyenes).
- Az átmenetnek függetlennek kell lennie az állapot nyomonkövetésére
használt, mért jellemzőtől (fluoreszcencia, elnyelés, CD, NMR, stb.)
- A Van't Hoff-entalpiának meg kell egyeznie a kalorimetrikus entalpiával
Kinetikus kísérlet
A sebességi állandók mérése
- A teljes jellemzéshez különféle denaturálószer-koncentrációk mellett
mérjük a fel- vagy legombolyodás sebességét:
- Alacsony denaturálószer-koncentrációknál felgombolyodási kísérleteket
végzünk: teljesen denaturált állapotból hirtelen kihigítjuk a
denaturálószert úgy, hogy alacsony legyen a koncentrációja
- Magas denaturálószer-koncentrációknál legombolyodási kísérleteket végzünk:
teljesen natív állapotból denaturálószer hirtelen hozzákeverésével indítjuk
a folyamatot
- A keverés után valamilyen optikai jel (pl. fluoreszcencia, cirkuláris
dikroizmus, abszorpció) időfüggését mérjük.
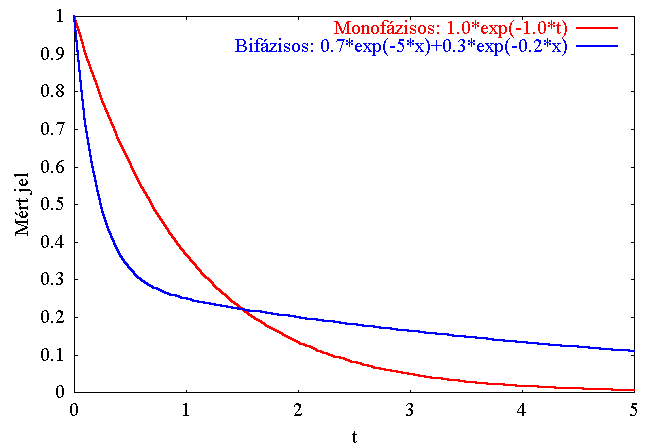
- A mért jel időfüggésére exponenciális lecsengések összegét illesztjük:
I(t) = I0+A1exp( -
k1t) + A2exp( -
k2t) + ...
(itt t az időt jelenti!)
- Ai : amplitúdók,
ki : sebességi állandók (vagy taui=1/ki
időállandók)
- Ha egy exponenciális elég, akkor monofázisos az időfüggés, ha
kettő kell, akkor bifázisos, stb.
A kinetika elméleti leírása és a mérés értékelése kétállapotú rendszernél
- Kétállapotú viselkedésnél a natív és a denaturált állapotot egymástól
egyetlen energiagát választja el, ez az átmeneti állapot.
- Ha van egy átmeneti állapot (jele: t, transition state), feltehetjük, hogy annak
szabadentalpiája is lineárisan függ a denaturálószer-koncentrációtól:
Gt(D)
= Gt,víz - mtD
és mt-vel jelöljük a függés meredekségét.
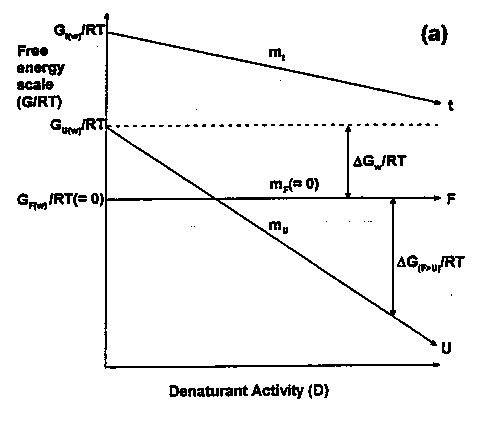
(mindent a felgombolyodott állapothoz viszonyítva
(GF-et tekintsük 0-nak bármely D-nél) a delták elhagyhatók;
az ábrán még RT-vel is osztották a szabadentalpiákat, ezt most hagyjuk
figyelmen kívül).
- A fel- és legombolyodás sebességi állandói az aktiválási energiáktól
függenek:
- A legombolyodás aktiválási energiája: Gt, így
kle = k' exp( -
Gt/RT)
- A felgombolyodás aktiválási energiája: Gt -
GU, így
kfel = k' exp( -(Gt -
GU)/RT)
- Kinetikai mérésnél az egyensúlyból való kibillenés
(a denaturálószer-koncentráció hirtelen megváltozása) utáni relaxáció (új
egyensúlyi állapot felvételének folyamata) sebességét mérjük. Ennek megfigyelhető
sebességi állandója (ezt kapjuk meg az optikai jel időfüggéséből a fentebb
leírt illesztésből):
kmegfigy = kfel +
kle
- A D-től való függést bevive és az egyenlet logaritmusát véve kapjuk:
ln kmegfigy = ln (kfel,víz
exp((mU - mt)D) + kle,víz
exp(- mt D))
- Ezt mérési adatok alapján ábrázolva kapjuk az ún. chevron
plotot:
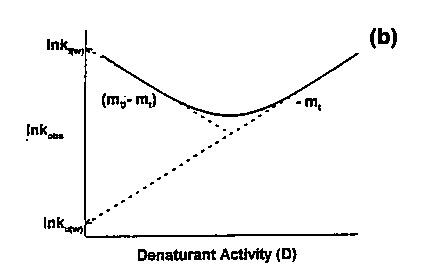
Jellegzetes, V alakú plot (chevron: fordított V alakú katonai
rangjelzés). A V alak abból adódik, hogy alacsony denaturálószer-koncentrációnál
a felgombolyodás, magasnál a legombolyodás sebessége nagy, közepesnél mindkettő kicsi.
- Jobb oldali ág: legombolyodási ág (legombolyítással mérhető),
meredeksége -mt, tengelymetszete ln kle,víz
- Bal oldali ág: felgombolyodási ág (felgombolyítással mérhető),
meredeksége mU - mt, tengelymetszete ln
kfel,víz
- A mérésből meghatározható mt és mU. (Az
mU egyensúlyi mérésből is, ld. fentebb.)
- mt arányos az átmeneti állapotban hozzáférhetővé
váló felszínnel
- (mU - mt)/mU az
átmeneti állapot pozícióját jellemzi (hol van a reakciókoordinátán)
- D denaturálószer-koncentráció: valójában az aktivitással
kell(ene) számolni, ez nemlineáris függvénye a koncentrációnak, néha
alkalmazzák
A kinetika kétállapotúságának feltételei
- A fel- és legombolyodásnak is monofázisosnak kell lennie
- ln kmegfigy -nek a fenti egyenlet szerint kell függnie a
denaturálószer-koncentrációtól: a chevron plot mindkét ágának egyenesnek
kell lennie.
- A kinetikus kísérletekből számolt paraméterek értékeinek (egyensúlyi állandó
KU=kfel/kle,
mU=[felgombolyodási ág meredeksége] + [legombolyodási ág
meredeksége]) meg kell egyeznie az egyensúlyi kísérletekből nyert értékekkel.
Példák kétállapotú viselkedést mutató fehérjékre
Példa: Kimotripszin inhibitor 2
Szerkezete
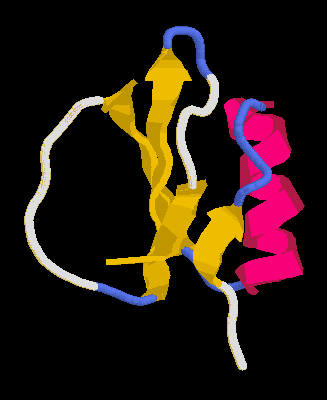
64 aminosav, egy négyszálú béta-lemez és egy hélix
Egyensúlyi kísérlet
GdnHCl denaturáció fluoreszcenciával követve:


Az egyensúlyi kísérletben pontosan illeszkedik a kétállapotú modellre.
Kinetikai kísérlet:
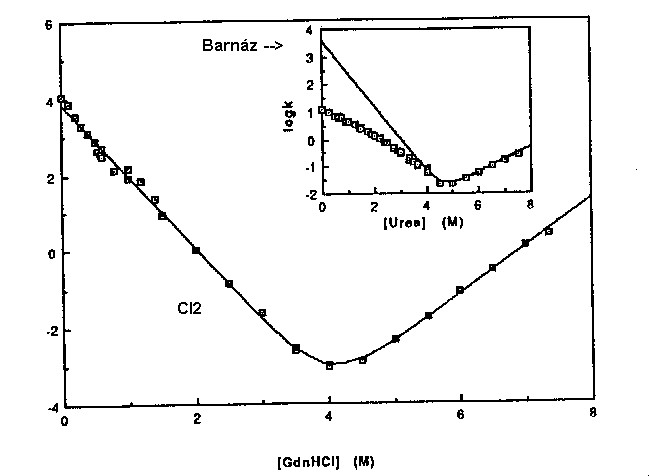
A kinetikai kísérletben is pontosan illeszkedik a kétállapotú modellre.
Inzert: ugyanez barnázon kimérve (a felgombolyodási ág nemlineáris --> nem
kétállapotú viselkedés).
Egyetlen kooperatív egység. Egyéb kísérletek kimutatták: a másodlagos és
a harmadlagos szerkezet egyidejűleg alakul ki, a hierarchikus modell itt nem
teljesül! A kimotripszin inhibitor 2 minden tekintetben tökéletesen
kétállapotú viselkedést mutat.
Egyéb, kétállapotú viselkedést mutató fehérjék
- Számos kis, egydoménes fehérje, pl.
- Alfa-helikális fehérjék: monomerikus lambda represszor, citokróm c
(speciális körülmények között)
- Béta-fehérjék: tendamisztát, CspB hidegsokk-fehérje, SH3 domének
- Béta-szendvicsek: twitchin, tenascin, stb.
- Alfa/béta fehérjék: Kimotripszin inhibitor 2, Arc represszor,
ubiquitin (pontmutáns), villin, stb.
- Nagy változatosságot mutatnak kfel-ben is és az
átmeneti állapot pozíciójában is
- Legfeljebb kb. 100 aminosavrészből állnak (a legnagyobb 107).
- Némely esetben a kétállapotú viselkedés könnyen megszüntethető
(mutáció, körülmények változtatása)
- A felgombolyodás kinetikai paramétereit elsősorban a fehérje
topológiája határozza meg (hasonló topológia --> hasonló paraméterek)
- Másodlagos szerkezet: alfa-helikális fehérjék gyorsabban gombolyodnak-e
fel, mint a béta-szerkezetűek? Van korreláció, de sok a kivétel.
- Lokális/nemlokális kontaktusok száma összefügg-e a felgombolyodási
sebességgel? Van némi korreláció. (Több nemlokális kontaktus --> lassúbb
gombolyodás)
Többállapotú viselkedés
Példa: lizozim és a foszfoglicerát kináz (PGK)
izolált N-terminális doménje
PGK N-domén (175 aminosav)
Egyensúlyi kísérlet:
GdnHCl denaturáció
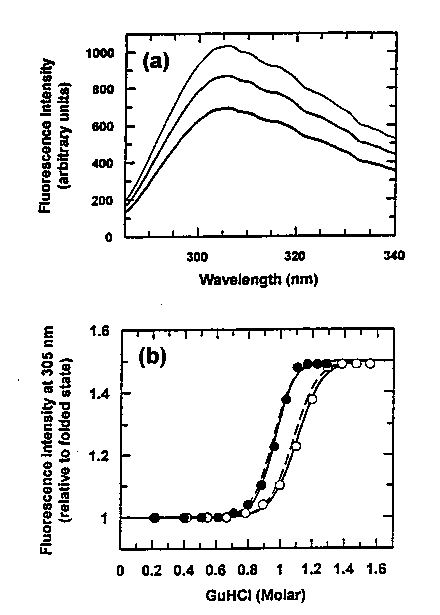
Szigmoid görbe, az egyensúly kétállapotú
Kinetikai kísérlet:
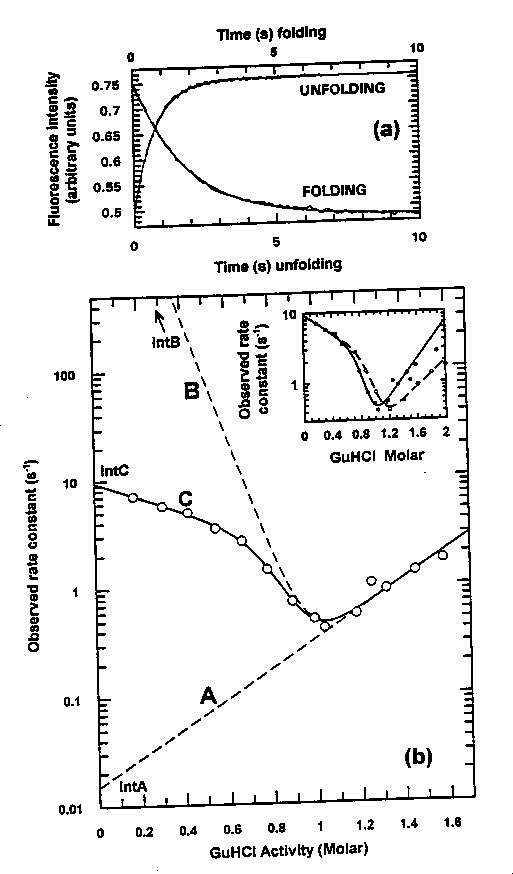
Fent: a fel- és legombolyodás relaxációs görbéi: monofázisosak
Lent: a chevron plot felgombolyodási ága nemlineáris --> kétállapotú
modellnek nem felel meg.
Az adatok illeszthetőek háromállapotú modellre:
U = I = F
Lizozim (129 aminosav)
Szerkezet
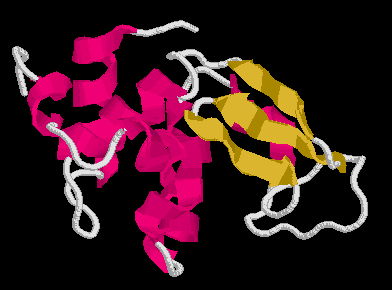
Tyúktojás-lizozim: egy alfa és egy béta domén
Egyensúlyi kísérlet:
szigmoid görbe, kétállapotú egyensúly
Kinetikai kísérlet
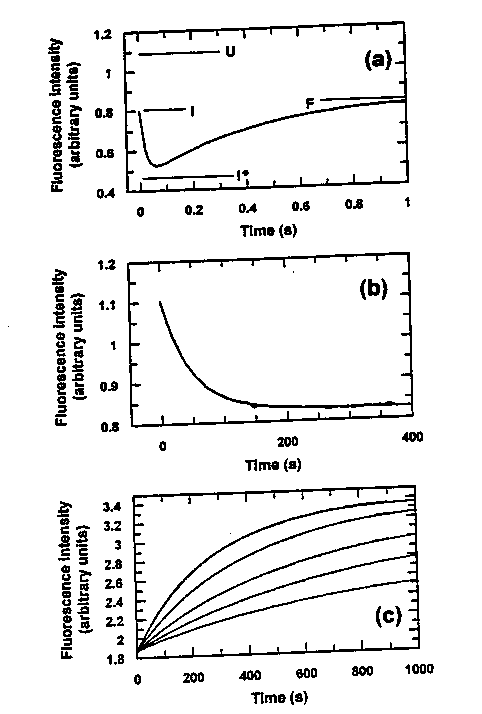
- (a): 5,4-ről 0,49 M GdnHCl-re higítás. Háromfázisú kinetika:
(1) Ugrásszerű csökkenés (holtidőben), (2) gyors csökkenés, (3) lassabb emelkedés
- (b): 5,4-ről 2,8 M GdnHCl-re higítás. Egyfázisú kinetika, lassú.
- (c): Denaturációs átmenetek: sima egyfázisú görbék
Chevron plot: ha több fázis van, mindegyik fázis sebességi
állandója alapján készíthetünk chevron plotot:
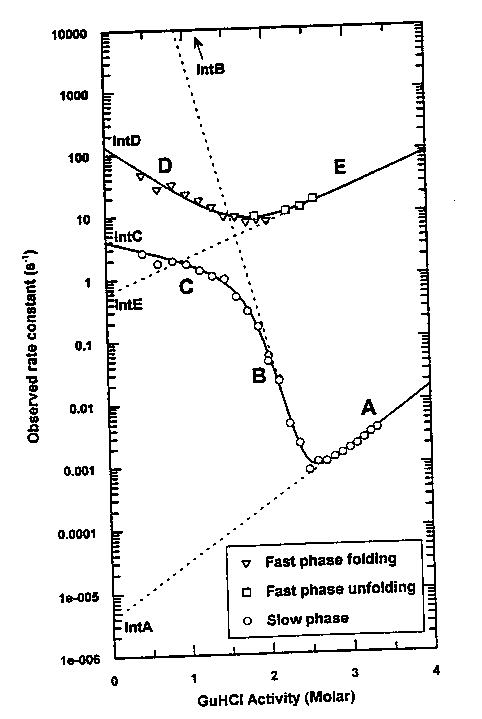
- Felső görbe a gyors, alsó a lassú fázisok sebességi állandói alapján
- Felgombolyodási ág nemlineáris --> nem teljesül a kétállapotú kinetika
- Az adatok négyállapotú modellre illeszthetők:
U = I = I* = F
A lizozim felgombolyodása tehát különösen komplex: négyállapotú
felgombolyodás!
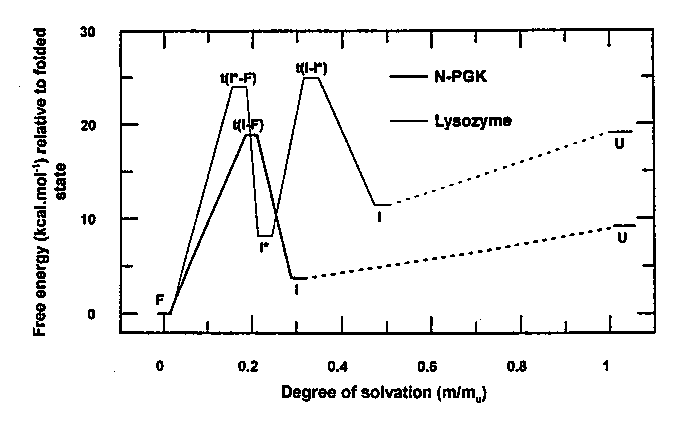
Szabadentalpia-profilok
A mérések alapján meghatározható az átmeneti állapotok és a köztes
állapotok szabadentalpiája és reakciókoordinátán vett pozíciója
(reakciókoordináta: a natív állapotban eltemetett felszínek
hozzáférhetősége az adott állapotban, ez az mU és
mt értékekből származtatható). A PGK-ra és a lizozimre a
fenti mérések alapján a következő szabadentalpia-profilok adódnak:
Egyéb, többállapotú viselkedést mutató fehérjék
- A 100 aminosavnál hosszabb fehérjék általában, pl. barnáz, lizozim,
GroEL chaperonin apikális doménje, ribonukláz H, izolált PGK-domének,
citokróm c (bizonyos körülmények között)
- Nem különböznek lényegesen a kétállapotúan gombolyodó fehérjéktől sem a sebességi
állandókban, sem az átmeneti állapot pozíciójában, sem a térszerkezet
komplexitásában
- Általában nagyobb a stabilitásuk, mint a kétállapotúaknak
- Néha stabilizálással kétállapotú fehérjét háromállapotúvá,
destabilizációval háromállapotút kétállapotúvá lehet alakítani
- A felgombolyodást kinetikus csapdák, hibásan gombolyodott köztitermékek
komplikálják
Hidrogénkicserélődéses módszerek
Hidrogénizotóp-kicserélődés
- Fehérjét nehézvízbe helyezve a labilis protonok deuteronra (deutérium
magja) cserélődnek.
- A kicserélődés sebességi állandója (teljes hozzáférés esetén):
kc = kH[H+] +
kOH[OH-]
sav- és báziskatalizált, minimuma pH=3-nál (pH=3-nál a leglassúbb, ettől
eltérve gyorsul)
- Denaturált fehérjénél oldalláncok szekvenciafüggő módon befolyásolják a
kicserélődést.
- Felgombolyodott fehérje belsejében lévő protonnak előbb felszínre kell
kerülnie.
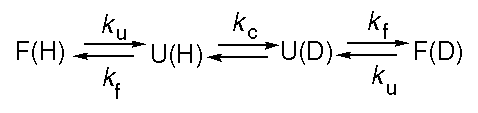
(U a denaturált, F a natív állapot, H a hidrogén, D a deutérium)
- Ha a felgombolyodott állapot energetikailag erősen kedvező, akkor
kf >> ku, így a megfigyelhető
kicserélődési sebesség:
kex =
kukc/(kf +
kc)
Két határeset:
- EX2 mechanizmus: kf >>
kc esetén: szerkezeti fluktuáció gyors a kicserélődéshez
képest (kicserélődés-limitált mechanizmus). Ekkor
kex = Kopkc
ahol Kop a protont rejtő hely felnyílásának egyensúlyi
állandója. Reciproka: P=kc/kex a
védettségi tényező. A kicserélődés sebességét az éppen kinyílt
állapotban lévő proton relatív koncentrációja határozza meg. Sok kinyílás
kell egy kicserélődéshez.
- EX1 mechanizmus: kf << kc
esetén: szerkezeti fluktuáció lassú a kicserélődéshez képest
(felnyílás-limitált mechanizmus). Ekkor
kex = ku
a kicserélődés sebességét a kinyílási sebesség határozza meg: minden
kinyíláskor csere van.
- EX2 a leggyakoribb eset. EX1 akkor valósul meg, ha
a fehérje destabilizált (lassan gombolyodik fel) vagy ha erősen bázikus a pH
(gyors a kicserélődés).
- A két mechanizmus elkülönítése: pH-függés alapján.
- EX2-nél a kc erős pH-függése jelenik meg
- EX1-nél csak ku esetleges pH-függése
Pulse-labelling (impulzusjelöléses) hidrogénkicserélődés
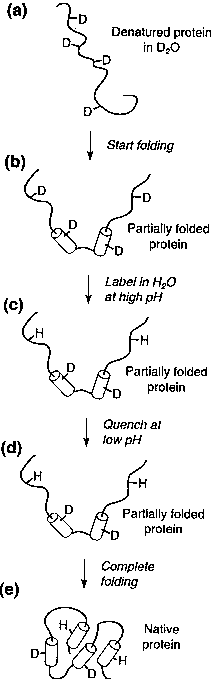
|
- teljesen deuterált, denaturált fehérje (előzőleg nehézvizes denaturálószerben
áztattuk sokáig)
- elindítjuk a felgombolyodást, majd adott tf idő múlva
- magas pH-n egy adott időtartamú, H2O-val készített
pufferlökettel (impulzus) megjelöljük a hozzáférhető protonhelyeket
(ezeken a helyeken a deuteronok protonokra cserélődnek). Ezzel
lényegében pillanatfelvételt készítünk a fehérje adott állapotáról.
- alacsony pH-jú pufferrel megállítjuk a kicserélődést, hogy a védettebb
deuteronok megmaradhassanak (a H-kötésben lévők). (Ha hagynánk a magas pH-jú
puffert, egy idő után mindegyik deuteron protonra cserélődne.)
- hagyjuk befejeződni a felgombolyodást
- a jelölt mintát NMR-rel vagy tömegspektroszkópiával vizsgáljuk: NMR-rel
a kicserélődött protonok helye azonosítható, tömegspektroszkópiával a számuk
és heterogén minta esetén az eloszlásuk is
- A kísérletet tf változtatásával sokszor megismételjük,
így pillanatfelvételeket készítve a felgombolyodás folyamatáról, különböző
időpontokban.
|
Kísérleti elrendezés:
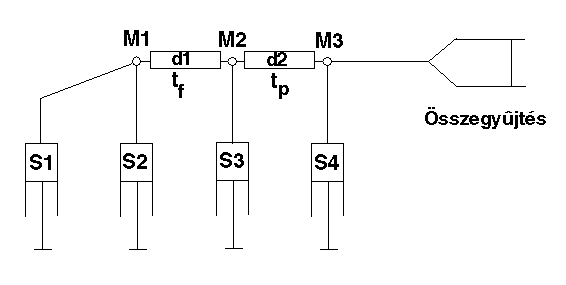
S1: denaturált fehérje nehézvízben
S2: visszagombolyító puffer
S3: impulzuspuffer (magas pH, H2O
S4: leállító puffer (alacsony pH)
M1, M2, M3: keverések
tf: visszagombolyodási idő (a jelölés előtt)
tp: impulzusidő
Koncentrációváltozások az idő függvényében:
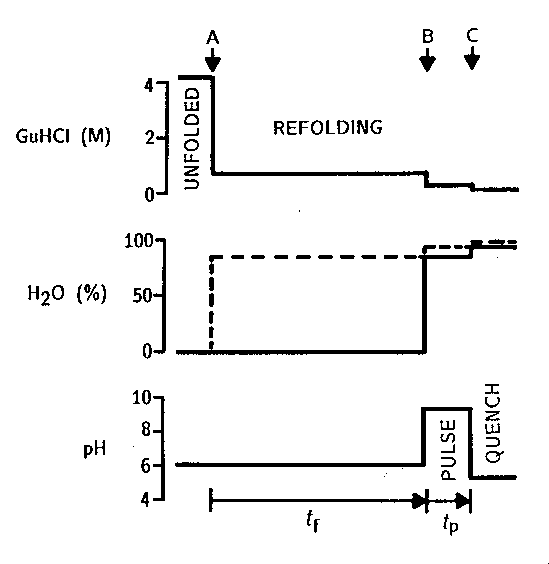
Mért mennyiség:
- a fehérje egyes régióiban lévő protonok
jelölhetősége a felgombolyodásra hagyott idő függvényében. (Minél hosszabb
ideig hagyjuk menni a felgombolyodást a jelölés előtt, annál kevesebb
molekulában lesznek még hozzáférhetőek a jelölhető protonok, tehát a
jelölhetőség csökken!)
- az egyes protonok védettségi tényezője (ez növekszik a
felgombolyodási idő előrehaladtával)
Példák a felgombolyodás részletes jellemzésére
Lizozim felgombolyodásának vizsgálata
Impulzusjelöléses hidrogénkicserélődés, NMR-rel követve
Különböző régiók jelölhetőségének csökkenése az idő függvényében:
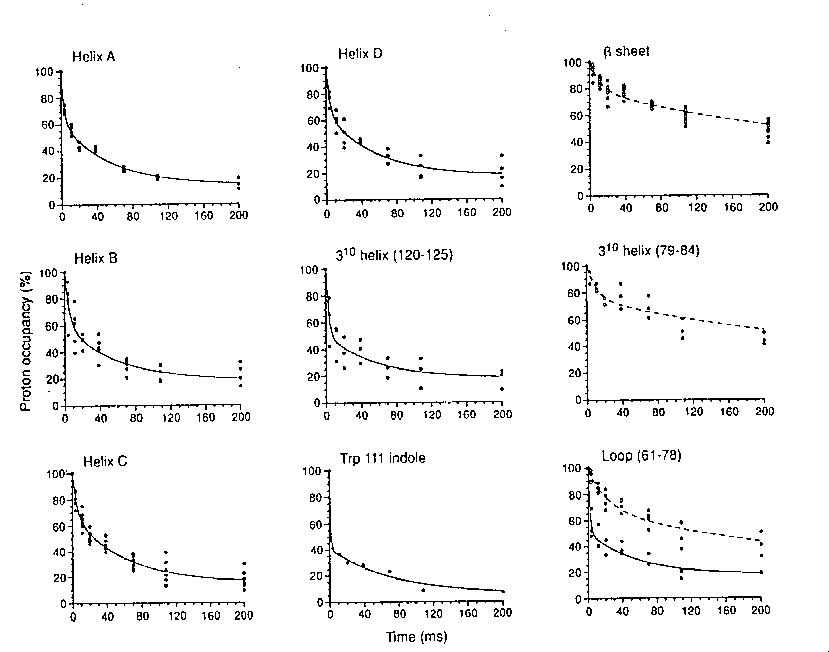
- A görbék nem esnek mind egybe --> vannak intermedierek
- Bifázisos görbék
- Gyors fázis: 7 ms körüli időállandó. Amplitúdója a hélixeknél 40%, a
béta-doménnél csak 24%
- Lassú fázis: a hélixeknél <100 ms időállandó, a béta-doménnél
>100 ms
- az alfa-domén minden görbéje kb. ugyanolyan, mindkét fázis --> a
domén magja kialakulhat, miközben a béta még nem stabilizálódott
- Szekvenciális események vagy párhuzamos utak?
A bifázisos görbék két lehetséges magyarázata:
- A gyors fázisban az adott proton az összes molekulában
részleges védettséget szerez, egy gyengén stabil köztitermékben. Ez a lassú
fázisban alakul át stabilabb szerkezetté. (Egy közös út.)
- Az adott amidcsoport a molekulák egy részében teljes védettséget
szerez, a többiben semmit. Az utóbbi frakció a lassú fázisban szerzi meg a
védettséget. (Két párhuzamos út.)
Hogyan különíthető el?
- 1. esetben EX2, 2. esetben EX1 mechanizmus
működik, így a két eset a pH-függés alapján elkülöníthető. Eredmény:
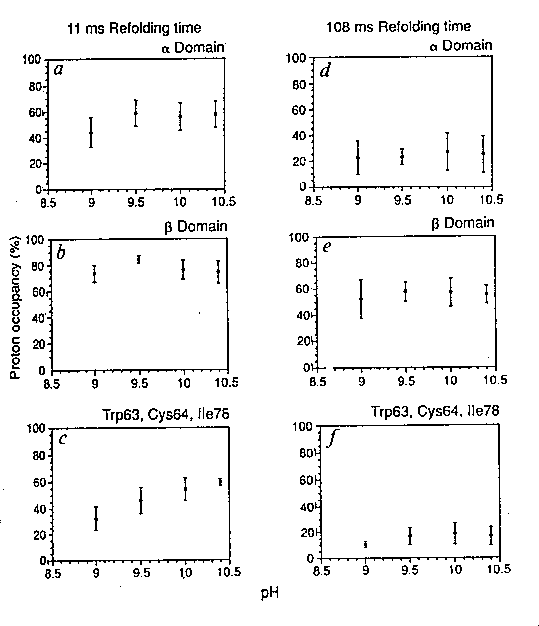
- Többnyire nincs kivehető pH-függés --> több párhuzamos út van
Cirkuláris dikroizmus, stopped-flow méréssel
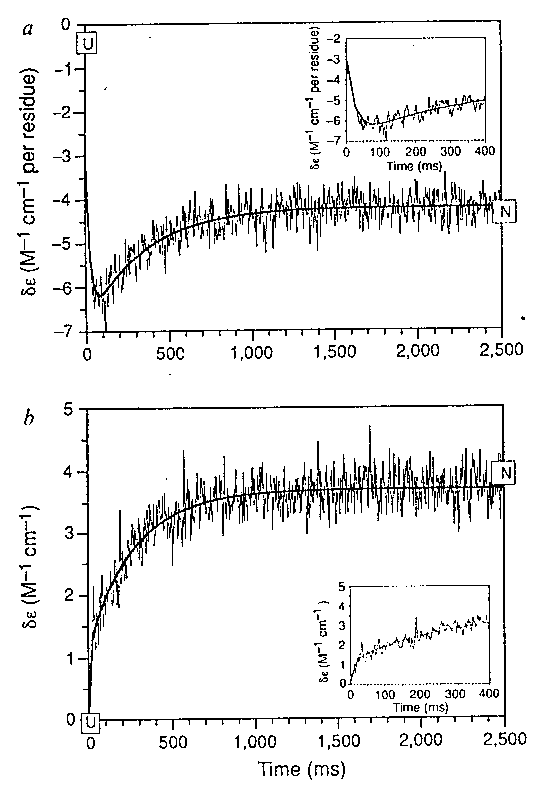
Impulzusjelöléses hidrogénkicserélődés tömegspektroszkópiával mérve
(electrospray ionization mass spectrometry)
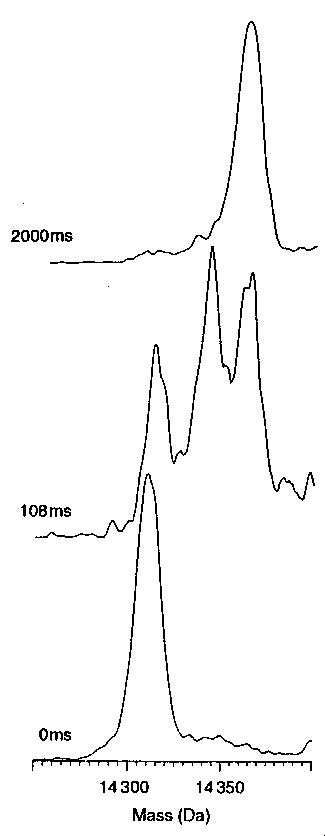
Jól látható a köztes állapotok heterogenitása. Egy köztitermék különösen
nagy mennyiségben található, ebben az alfa-domén már létrejött, a béta nem.
Egyéb mérések
triptofánok fluoreszcenciája, fluoreszcencia quenching, ANS-kötés,
inhibitorkötés, stb.
Az összkép:
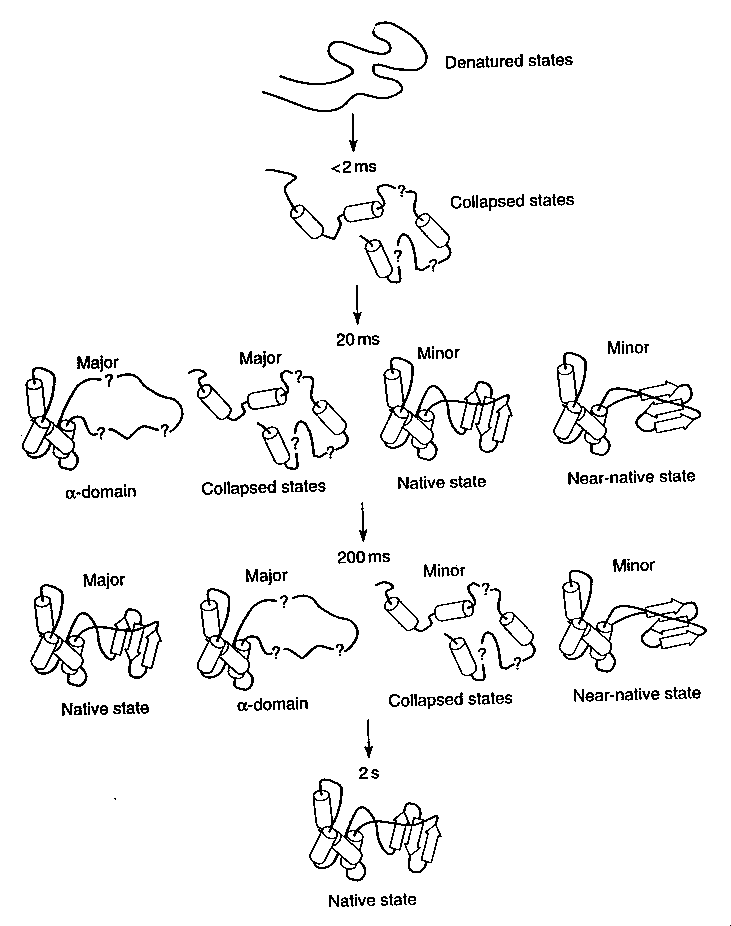
- Legkorábbi állapot (<2 ms): részlegesen összeesett, fluktuáló, jelentős
másodlagos szerkezet, nincsenek stabil harmadlagos kölcsönhatások.
- Az alfa-doménben stabil szerkezet alakul ki, a béta-domén még instabil
és fluktuáló. Kis mennyiségben feltűnik egy másik köztitermék is, amiben
mindkét domén megvan, de még nem álltak össze natívvá
- 200 ms: túlnyomórészt majdnem kész alfa-domént tartalmazó köztitermékek.
Lassú folyamatban (350 ms időáll.) kialakul a béta-domén és mindkét domén
magjának finomszerkezete.
A molekulák 25-30%-a gyorsan gombolyodik (ezeknél 5-10 ms
időállandóval mindkét domén létrejön), 70-75%-a lassan (ezeknél a béta domén
csak lassan alakul ki).
Citokróm c felgombolyodásának vizsgálata
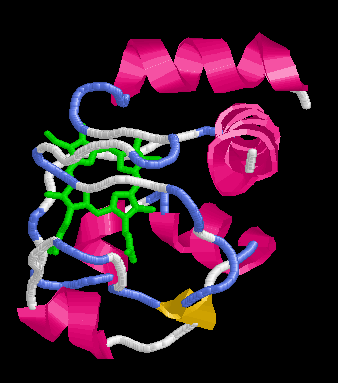
Szerkezete: helikális, hem csoporttal
Cirkuláris dikroizmus stopped-flowval
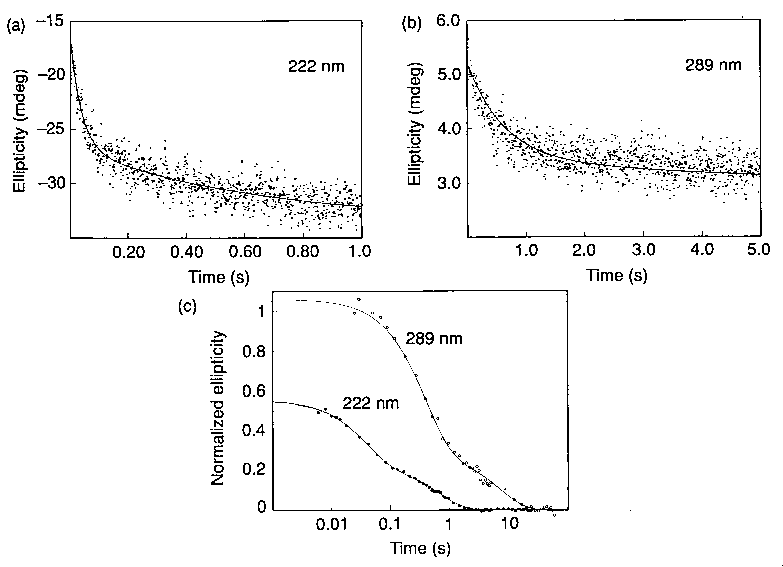
- Távoli UV: holtidőn (4 ms) belül a változás 45%-a megtörténik, majd
kétfázisú görbe
- Közeli UV: nincs gyors változás, mintegy 100 ms-ig alig változik, utána
lassú lecsengés
Különféle mérések
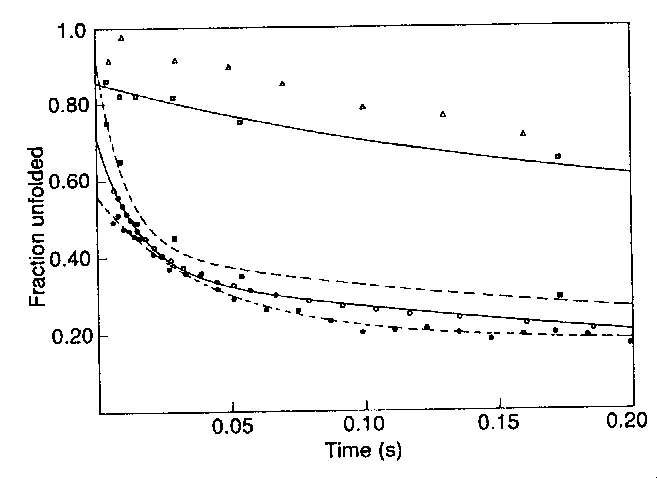
- Gyors időállandóval fejlődik:
- Távoli UV CD (másodlagos szerkezet)
- N- és C-terminális hélixek amidprotonjainak védettsége -- a mért
értékek hasonlósága arra utal, hogy ezek korán asszociálódnak
- Trp 59 fluoreszcenciájának kioltása a hem csoport által (gyors
kollapszusra utal)
- Lassú időállandóval fejlődik:
- Közeli ultraibolya tartományban a cirkuláris dikroizmus (harmadlagos
szerkezet)
- Lánc közepén lévő hélixek amidprotonjainak védettsége
Burst-fázis: holtidőn belül a legtöbb fehérjénél megugrás a távoli
UV CD-ben. Újabb eredmény: ez lehet az oldatcserétől is, nem feltétlenül
tükröz szerkezeti változást.