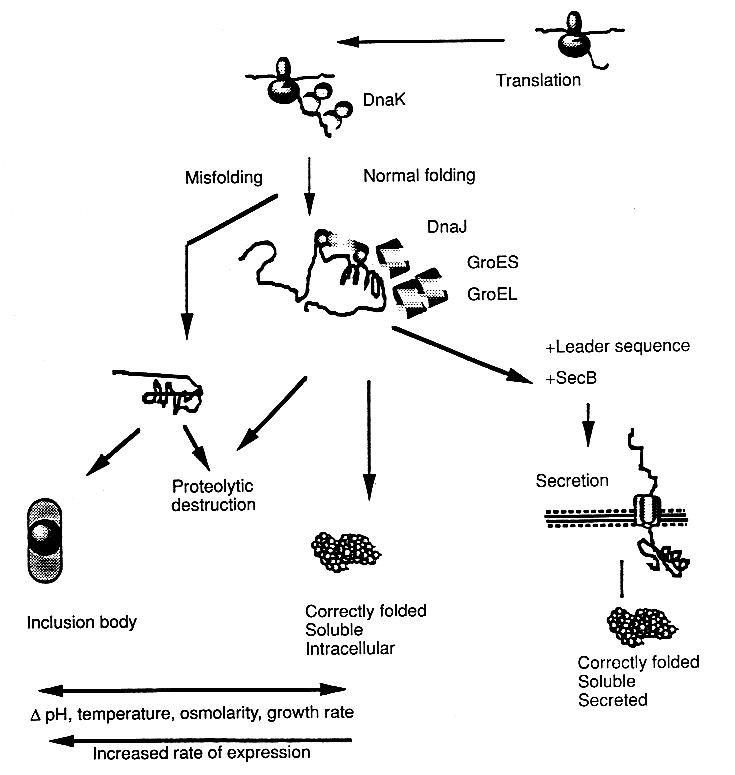
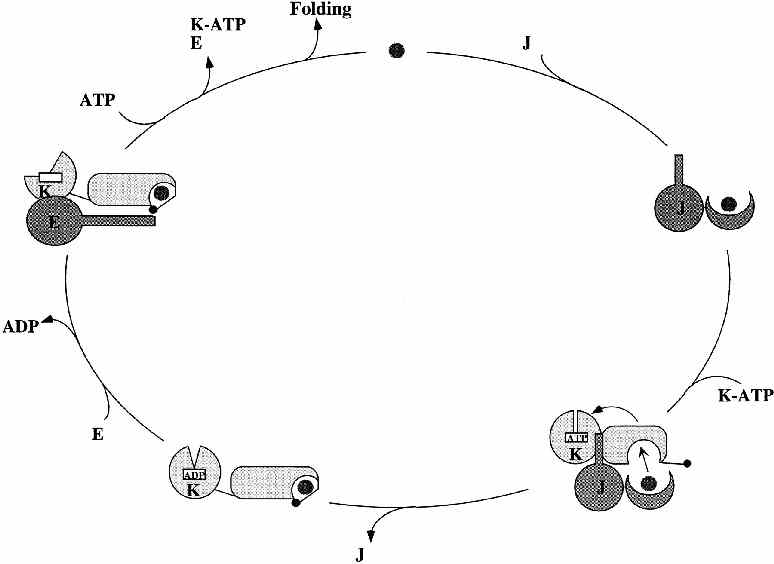
Az ADP helyére bejön egy ATP. A zseb felnyílik, a szubsztrát kiszabadul.
A GrpE leválik. Kezdődhet a ciklus elölről.
- Általában többször ismétlődik a szubsztrát kötése és disszociációja
- A disszociált szubsztrát lehetőségei:
- felgombolyodik
- aggregálódik
- visszaköt a Hsp70-hez
- más chaperonhoz köt
A Hsp60 chaperoncsalád (chaperoninok)
- Chaperonin: kezdetben egy olyan csoportnak adták a nevet, amit
prokariotákban, valamint mitokondriumokban és kloroplasztiszokban találtak.
Később eukariota citoplazmában is felfedezték.
- Stressz hatására indukálódik, de normálisan is sok van belőle
- segíti a fehérjék felgombolyodását, főleg "misfolded"
("félregombolyodott") állapotból
- segíti az oligomerizációt (a monomerek helyes felgombolyodásának
elősegítésével)
- E. coliban GroEL, GroES: életfontosságú fehérjék
- GroEL: az E. coli összes fehérjéjének felét köti legombolyodott állapotban
- fehérjeszintézisnél és membrántranszportnál is kötődik a polipeptidekhez
- Kloroplasztiszban: RBP Rubisco Binding Protein: hozzákötődik a Rubisco
nagy alegységeihez, amíg a kis alegységek meg nem érkeznek a citoplazmából
- Legjobban jellemzett: E. coli GroEL, GroES
A GroEL/ES szerkezete
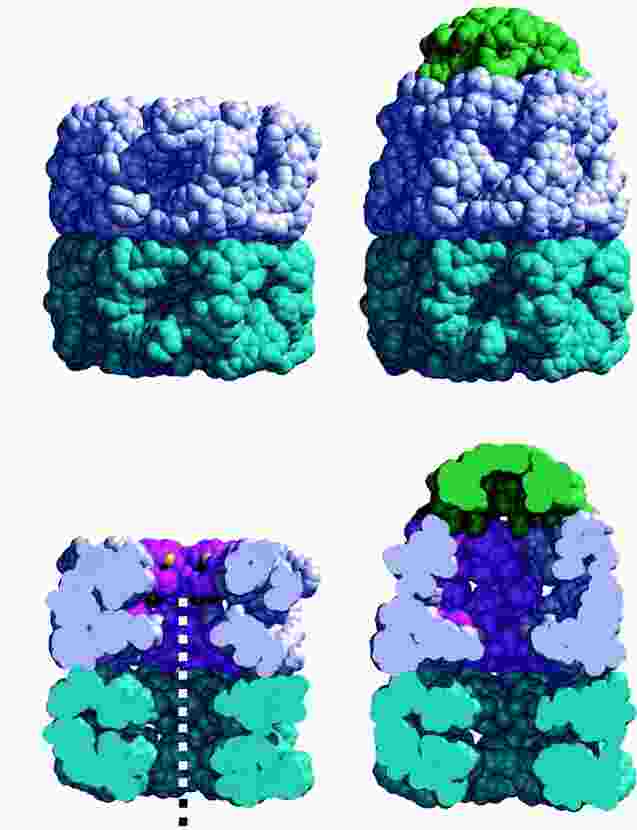
- GroEL: 2x7 alegységből álló, gyűrű alakú komplex, közepén nagy üreggel
- GroES: 7 db, 10 kDa alegységből álló gyűrű
Két fő állapot:
- peptidfogadó állapot (ábra bal oldal): az üreg nyitott a külvilág
felé, belső hidrofób felszíne köti a szubsztrátfehérjét
- felgombolyodás-aktív állapot (ábra jobb oldal): ATP-kötés és a
GroES sapka bekötődése révén jön létre. Az üreg megnő, a GroES kupolája
lezárja. Az üreg falának jellege megváltozik (inkább hidrofil lesz). Az
üregben lévő fehérje felgombolyodik.
Átkapcsolás a két állapot között
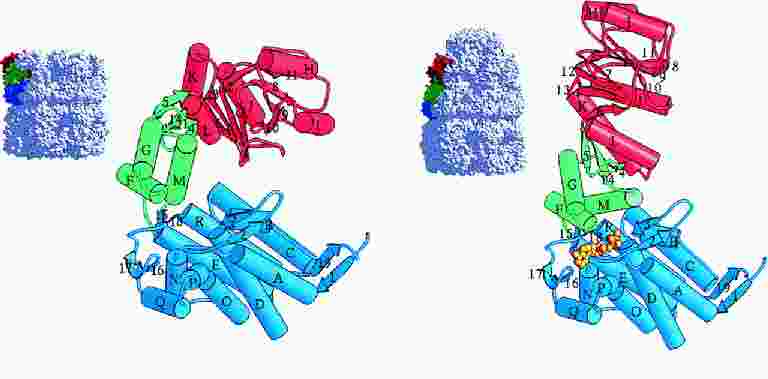
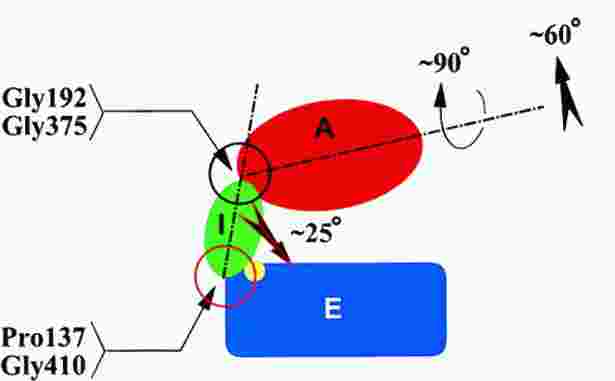
- A GroEL alegység 3 doménből áll: apikális (a csúcsnál), ekvatoriális (a
komplex középvonala felé eső), köztes (a kettő között)
- Az átkapcsolásnál nagyszabású doménmozgások történnek:
- A köztes domén 25 fokkal lehajlik, bezárva az alatta az ekvatoriális
doménben lévő ATP-t
- Az apikális domén 65 fokkal felhajlik, azaz nagyban megemelődik, s
eközben hossztengelye körül is 90 fokkal elfordul
- Az üreg térfogata kétszeresére nő
- Teljesen megváltozik az üreg falának a jellege, a szubsztrátfehérje
leválik a falról
A két gyűrű együttműködése
- Az egyik gyűrűben az ATP-k bekötődése (7 db!) kiváltja a másik gyűrűben
az ES sapka és az ADP-k disszociációját
- Az ES kötése az egyik gyűrűhöz erősen gátolja egy másik ES kötését a
másik gyűrűhöz
- Egy gyűrűn belül az ATP-k kötése kooperatív, a másik gyűrű ATP-kötését
viszont hátráltatja
Az ATP-kötés és az ATP-hidrolízis szerepe
- ATP-kötés:
- a GroES kötéssel együtt ez idézi elő az átkapcsolást a
felgombolyodás-aktív állapotba, azaz a nagyléptékű doménmozgásokat
- a másik gyűrűnél kiváltja a GroES és az ADP-k lelökődését
- ATP-hidrolízis:
- meggyengíti a GroES kötődését, hogy az később leválhasson
- ezáltal továbblépteti a "gépet" a következő állapotba
Időtartamok (23 Celsius-fokon)
- Az üregbe bekötődik a felgombolyítandó fehérje
- Kötődik az ATP és a GroES
- 1 másodperc múlva megtörténik az átkapcsolás, a szubsztrátfehérje
leválik az üreg faláról és elkezd felgombolyodni
- 5-10 másodperc múlva megtörténik az ATP hidrolízise
- A szubsztrátfehérje még további 10-15 másodpercet tölt a zárt üregben,
próbál gombolyodni (összesen kb. 20 másodperce van)
- ezután megtörténik a GroES lelökődése, a szubsztrátfehérje távozik
Hatékonyság: több mint 90%-ban sikeres felgombolyítás
A működés sémája
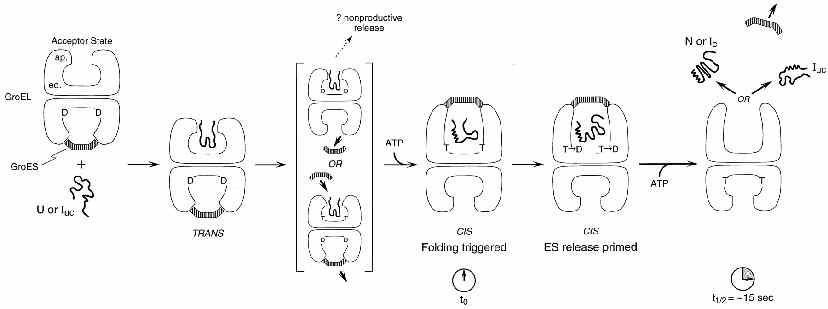
- Valószínűleg kétütemű működés (hol az egyik, hol a másik üreg dolgozik)
Nyitott kérdések
- Milyen konformációban kötődik a szubsztrátfehérje? (Valószínűleg
részlegesen felgombolyodott, félregombolyodott, olvadt gombóc jellegű)
- A kötődés növeli-e a szubsztrát legombolyodottságát?
- Az átkapcsoláskor a doménmozgás tovább gombolyítja-e le a szubsztrátot?
(Vsz. igen)
- Miután a szubsztrát levált a csatorna faláról, kölcsönhatásba lép-e még
vele, vagy úgy érzékeli, hogy semmi sincs körülötte (végtelen higítás)?
- Ha többször átmegy a szubsztrát a chaperonon, közben fejlődik-e az
állapota, vagy mindig ugyanabból az állapotból indul?
- Egyáltalán: mi történik a szubsztrát konformációjával az egész
folyamatban?
Felgombolyodási betegségek: amiloidózisok
- Amiloid: rostos fehérjelerakódások (extra- vagy
intracellulárisak), melyek betegségekkel járnak együtt
- Amiloidózisok: Lassan kialakuló, degeneratív betegségek
- Sok esetben azonosították a rostos lerakódások fő fehérjekomponensét:
Betegségek
| Fehérje | Betegség |
| ABri | Familial British
dementia |
|
alpha-Synuclein | Parkinson-kór |
| A-beta (amiloid béta-peptid) | Alzheimer-kór |
| Gelsolin | Finnish-type familial amyloidosis |
| Huntingtin | Huntington-kór |
| IAPP (islet amyloid polypeptide) | Type II
diabetes |
| Immunoglobulin VL domain | Light-chain amyloidosis |
| Lysozyme | Hereditary systemic amyloidosis |
| Medin | Aortic medial
amyloid |
| SAA (serum amyloid A) | Secondary systemic
amyloidosis |
| Tau | Alzheimer-kór, frontotemporal
dementia |
| TTR (transthyretin) | Senile
systemic amyloidosis, familial amyloid polyneuropathy |
- A rostok jellemzően "kereszt-béta" szerkezetűek: a hossztengelyre
merőleges béta-szálakat tartalmaznak
- A betegségek okai valószínűleg a lerakódások (a betegségre való hajlamot
fokozó mutációkról több esetben kimutatták, hogy növelik az adott fehérje
rostképző hajlamát)
- A résztvevő fehérjék sokfélék, natív szerkezetük között nincs hasonlóság
A rostképződés részlegesen fel-, ill. legombolyodott állapotból indul
- Több globuláris fehérjéről (lizozim, TTR, VL) kimutatták:
részlegesen le kell gombolyodniuk a rostképzéshez
- A fokozott rostképződést okozó mutációk ált. destabilizálják a natív
konformációt, növelve a részlegesen felgombolyodott állapot populációját
- Több fehérjéből sikerült részlegesen denaturáló körülmények között
rostképződést kiváltani
- Legombolyodott állapotban a legstabilabbak a következő peptidekn: amiloid béta
peptid (A-béta), IAPP, alfa-synuclein, tau. Az A-béta és a IAPP esetében
kimutatták: a rostképződést megelőzi egy olvadt gombóc jellegű, a natívnál
jóval több másodlagos szerkezetet tartalmazó állapot átmeneti jelentkezése
Proteolízis és rostképződés
- Számos amiloidogén fehérje egy nagyobb lánc proteolitikus fragmentuma
(pl. A-béta, ABri, medin, gelsolin).
- A proteolízisre való érzékenységet megnövelő mutációk növelik a peptid
mennyiségét --> nő a rostképződés valószínűsége
A rostképződés mechanizmusa: nukleációfüggő oligomerizáció
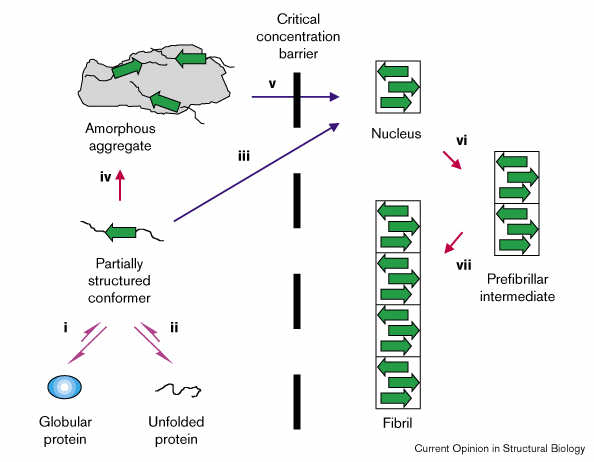
- Globuláris fehérjéből vagy legombolyodott fehérjéből részleges
szerkezetű amiloidogén intermedier keletkezik
- A némi béta-szerkezetet is tartalmazó intermedier rendezetlen, amorf
aggregátumokat képezhet, vagy
- ha a koncentráció meghalad egy kritikus értéket, akkor
rendezett önasszociáció révén béta-lemezes nukleuszt képez
- a béta-lemez növekedésével a szerkezet növekszik, oligomer, majd
fibrillum jön létre
Protofibrillumok
- A fibrillum ált. nem monomerek hozzáadásával növekszik, hanem
- hosszabb-rövidebb protofibrillumok jönnek létre, s ezek állnak
össze
- Elektronmikroszkópos kép: azt mutatja, hogy a protofibrillumok
gyöngysorszerűek, gömböcskékből állnak
- Több protofibrillum összecsavarodhat, így állnak össze fibrillummá
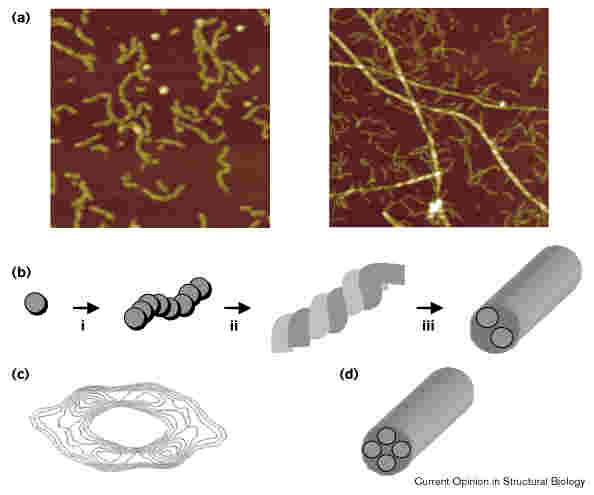
bal: gyöngysorszerű protofibrillumok; jobb: kész fibrillumok is
A rostok 3D szerkezete
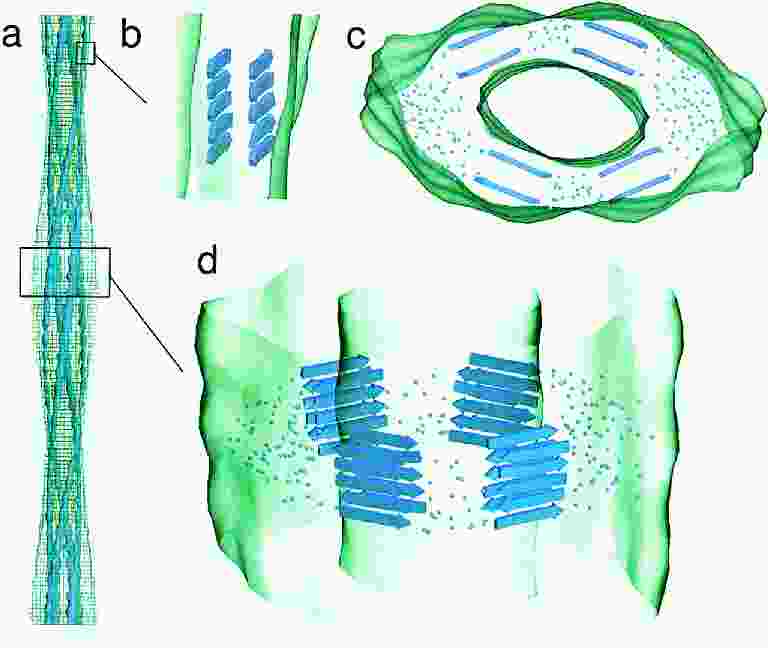
- Egy vastag rost több szálból (protofilamentumból) állhat
- Sokféle morfológia lehet (egyenes, görbült, csavart, nem csavart, stb.)
| Fehérje | Morfológia | Méretek (nm) |
| Acylphosphatase | Egyenes | d =
3–5 |
| alpha-Synuclein (wild-type, A53T, A30P) | Egyenes, csavart | d=10, h=8-10, d=10-19, d=12
|
| IAPP | Egyenes vagy kissé görbe, csavart |
h=5.2, p=49, h=6.8, p=25 |
| Abeta42 |
Egyenes | d =
7–10 |
| CspB
(residues 1– 22) | Egyenes | d =
10 |
| Gelsolin (residues 173– 243) | Egyenes vagy kissé görbe | d = 18–23 |
| Immunoglobulin VL domain | Egyenes | d
= 5 |
| Lithostathine (residues 12– 144) | Egyenes, sima | d = 30–50 |
| Medin (residues 286– 293) | Egyenes | d
= 7 |
| P22
tailspike beta-helix domain | Görbe, csavart | d =
50 |
| SAA (residues 1– 11) | Pálcika- vagy
szalagszerű, csavart | d = 4–7 |
(h: magasság, d: átmérő, p: tengely menti periodicitás)
További kutatási irányok
- A rostképződés in vivo mechanizmusa
- A környezet hatása (hőmérséklet, ionerősség, pH, redoxpotenciál)
- A felületek hatása (membránok közelsége)
- A betegség kialakulása (milyen káros hatása van a rostoknak, a
protofibrillumoknak, stb.)
Felgombolyodási betegségek: Prionbetegségek
- Prionbetegség: ez is amiloidózis, de fertőző
- Transmissible spongiform encephalopathies (átvihető szivacsos
agyvelőelváltozások), TSE
- marha: BSE, ember: Creutzfeldt-Jakob (CJD),
Gerstmann-Straussler-Scheinker (GSS), fatal familial insomnia (FFI)
A prionok tulajdonságai
- Normális, celluláris forma: PrPC
- központi idegrendszerben (nyirokszövetben, ideg-izom kapcsolatnál)
- funkciója nem ismert
- glikozilált sejtfelszíni fehérje, glikolipid horgony tartja
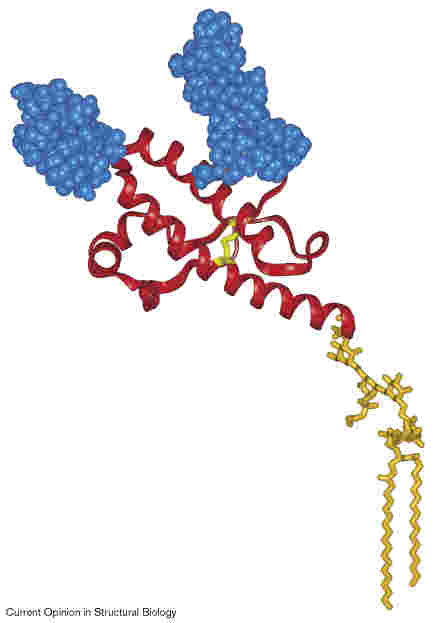
(NMR-szerk. alapján, 124-231 aminosavak, a többi rendezetlen)
- Kóros ("scrapie") forma: PrPSc
- csak konformációban tér el a PrPC-től
- önasszociáció révén stabil aggregátumokat képez
- senki sem tisztította még meg
- konformációja nem ismert
- ellenáll a proteináz K kezelésnek
Mi a fertőző ágens?
- Hipotézis: maga a PrPSc fertőzhet
- nukleinsav-mentes fertőző kivonatokat lehet készíteni
- --> "protein-only" hipotézis
- Különvélemények: nem a PrPSc (egyes kísérleti eredmények)
A terjedés modellje
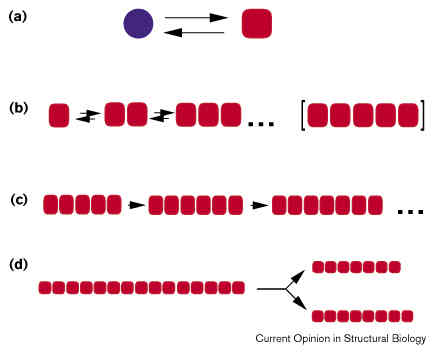
- (a) egyensúly a PrPC és a PrPSc között (utóbbi
ritka)
- (b) a PrPSc monomerek gyengén és reverzibilisen
asszociálódnak, míg ki nem alakul egy stabil, fertőzőképes mag
- (c) a kritikus méret elérése után a monomerek már irreverzibilisen
asszociálódnak hozzá a lánchoz, ami tovább növekszik
- (d) a fertőző részecske kisebb, stabil darabokra törve "szaporodik"
Másik modell: a PrPC átalakul egy köztes, PrP*
állapotba, ehhez hozzáköt a PrPSc és öntőformaként szolgálva
átalakítja PrPSc-vé.
Mindkét modell megmagyarázza, hogy a prionbetegség a következő módokon
alakul ki:
- a priongén öröklött mutációja miatt a PrPC kevésbé stabil,
könnyebben átalakul PrPSc-vé
- Kívülről bevitt PrPSc (táplálékkal vagy orvosi bevatkozásnál)
- Szomatikus mutáció
- Ritkán: spontán átalakulás
Felgombolyodási kísérletek
- Élettani körülmények között gyors, kétállapotú átmenet
- Savas pH-n (pH=4) jelentős egyensúlyi intermedier, túlnyomórészt
béta-szerkezetű, rostokká aggregálódik, ellenáll a proteináz K-nak.
Ez lehet a PrPSc felé vezető állapot.
Nyitott kérdések
- Valóban a prion a fertőző ágens?
- Mi pusztítja el a sejteket?
Egyéb felgombolyodási betegségek
Hibás felgombolyodás miatt az aktív fehérje hiánya által okozott
betegségek:
- Sarlósejtes vérszegénység: A hemoglobin béta alegységében Glu6-Val
pontmutáció miatt a deoxigenált hemoglobin oldhatósága csökkent, rostos
precipitátumokat képez. Sarló alakú vörösvérsejtek.
- Juharszirup-vizelet: az elágazó láncú aminosavak lebontását végző
mitokondriális alfa ketoacid dehidrogenáz enzimkomplex egyes részeiben fellépő
pontmutáció miatt az enzimkomplex nem szerelődik össze, ezért lebomlik.
Anyagcserezavar alakul ki.
- Fenilketonuria: fenilalanin hidroxiláz enzim pontmutációi miatt
az enzim könnyen aggregálódik, a fenilalanin felhalmozódik.
- Kollagénnel kapcsolatos betegségek: mutációk miatt
csontfejlődési, ízületi, bőrproblémák, stb.
- Cisztikus fibrózis: az esetek 70%-ában a CFTR fehérjében (cystic
fibrosis transmembrane conductance regulator) a Phe-508 deléciója okozza. A
mutáció miatt a CFTR nem gombolyodik fel jól, ezért nem hagyja el az
endoplazmás retikulumot és nem épül be a helyére, a hámsejtek membránjába,
ahol kloridionokat kellene transzportálnia. Ez többek között
tüdőfertőzésekhez vezet.
- A p53 tumorszupresszor fehérje mutációi: a p53 DNS-kötő fehérje,
a károsodott sejtek programozott sejthalálának kivitelezésében vesz részt.
Egyes mutációk miatt nem gombolyodik fel jól, ekkor a rák keletkezésének
valószínűsége megnövekszik, az emberi rákfajták felénél ez megfigyelhető.
- Szerpinekkel kapcsolatos betegségek: a szerpinek bizonyos típusú
szerin proteáz inhibitorok. Aktív formájuk metastabil, mutációk miatt rögtön
a stabilabb inaktív állapot alakulhat ki. Pl. véralvadási betegségek,
bizonyos tüdőbetegségek hátterében ez áll.
- Hályogok: károsodott krisztallin (szemlencsefehérje)
aggregációja miatt
Inklúziós testek renaturálása
- Rekombináns fehérjék sokszor inaktív, inszolubilis formában termelődnek
(idegen környezet miatt)
- Renaturáció: Sok milliárd dolláros biznisz
Inklúziós testek

Inklúziós testek E. coliban
- 0,2-1,5 mikron átmérőjűek
- igen tömörek, enyhén porózusak
- nem hasonlítanak az amorf fehérjeprecipitátumokra, inkább már-már
kristályszerűek
- ritkán kristály is létrejön
Szerkezetük
- Félregombolyodott fehérjék aggregátumai
- Sokszor nagymértékben natívszerű a szerkezet (doménaggregátumok?):
enzimaktivitás is részben megmaradhat
Képződésüket befolyásoló tényezők
- nincs egyszerű összefüggés semmilyen tényezővel
- fizikai tulajdonságok: fehérje töltésével pozitív korreláció
- gazdasejt élettani sajátosságai, fermentációs körülmények
- Kulcs: a tenyésztés hőmérséklete (alacsonyabb hőmérsékleten ált. kisebb
az inklúzióstest-képződés)
- pH, ozmolaritás, cukrok: direkt vagy indirekt módon befolyásolnak
- termelés intenzitása növeli
- sokkhatások: hősokkfehérjék termelése révén befolyásolnak
Az inklúziós testek kinyerése
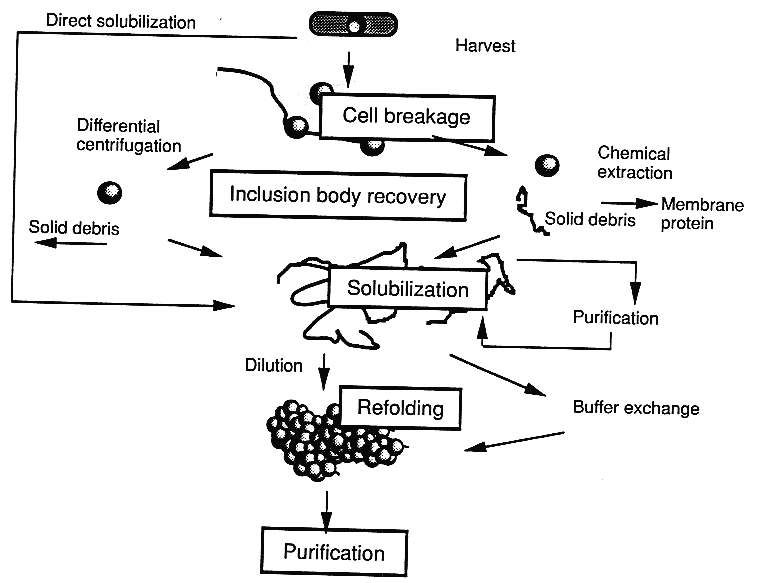 Stratégiák inklúziós testek renaturálására
Stratégiák inklúziós testek renaturálására
A sejtek feltárása
- A fermentációs oldatot lehűtjük, a sejteket lecentrifugáljuk vagy
leszűrjük meghatározott pufferben
- bármilyen módszer használható a feltárásra: az inklúziós testek igen
ellenállóak
- nagynyomású homogenizátor: 400 bar nyomással egy kis nyíláson át lapos
felületre spriccel, stb.
- a sejtek kijuthatnak a légtérbe, ez veszélyes lehet, ezért gyakran
előzőleg megölik őket (benzil-alkohol, oktánsav, kloroform, toluén, stb.)
Az inklúziós testek elválasztása
- Centrifugálás
- folyamatos üzemű, átfolyós, ipari centrifugában
- az átfolyási sebesség ügyes beállításával vagy ismételt
reszuszpenzióval és újracentrifugálással >90% tisztaság érhető el
- Szűrés
- rossz hatékonyságú, a szűrőmembrán hamar tönkremegy
Szelektív kémiai extrakció
- Ha sejttörmelék maradt a frakcióban, akkor abban membránfehérjék is
vannak, ettől meg kell szabadulni
- kezelés: kelátképző (EDTA), detergens (Triton X), 2M urea, stb.
A biológiailag aktív fehérje kinyerése
- Az inklúziós testben a fehérjéket erős nemkovalens erők tartják össze
- Első lépés ált. a szolubilizáció, ami teljes denaturálást jelent
- ezután visszagombolyítás
- Mellékreakciók: aggregáció + degradáció (proteázszennyezéstől):
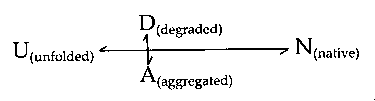
- empirikus receptek vannak, amelyek a felgombolyodás mechanizmusa
szempontjából semmit nem mondanak
Szolubilizáció
- Detergensek (Pl.: SDS, n-lauryl-sarcosine)
- Előnyök:
- aggregáció kevésbé fordul elő
- harmadlagos szerk és aktivitás megmaradhat
- Hátrányok:
- hozzákötődik a fehérjéhez és nehéz eltávolítani
- megzavarja a későbbi ioncserélő és hidrofób tisztítási lépéseket
- Kaotrop oldószerek (guanidin-hidroklorid, urea)
- koncentráció: kb. amennyinél a fehérje legombolyodik
- GdmCl: drága
- urea: olcsó, de cianátot képezhet, ami módosítja a fehérje
aminocsoportjait (az ureaoldat ioncserélésével és aminopuffer használatával
kivédhető)
- Extrém pH-k
- olcsó
- sok fehérjét irreverzibilisen módosíthat
- Szolubilizáló keverékek
- Urea + kaotrop
sók/ecetsav/dimetilszulfon/lúg/2-amino-2-metil-1-propanol, stb. : sikerrel
alkalmazták pár esetben
Renaturáció
Tisztítás: ált. nem érdemes refolding (visszagombolyítás) előtt tisztítani
Legfontosabb: aggregáció megakadályozása:
- Alacsony fehérjekoncentráció mellett egy lépésben higítás. Egyes
fehérjéknél nagy higítás kell --> nagy költség
- Higítás két szakaszban: előbb közepes denaturálószer-koncentrációra,
majd teljesen. Nagyon függ a fehérje- és denaturálószer-koncentrációktól:
sok játszadozás
- Aggregációcsökkentő pufferadalékok: pl. arginin, glicin,
polietilén-glikol
- Kémiai módosítás: pl. citrakonilálás az aminocsoportokat negatív
töltésűre változtatja, a fehérje polianionná válik, ez megakadályozza az
aggregációt, a módosítás reverzibilis
- Kovalens, reverzibilis immobilizálás pl. Sepharose oszlopra
- puffertartalmú micellákba zárjuk a fehérjemolekulákat (egyenként), majd a
micellákat szerves oldószerben diszpergáljuk
A diszulfidhidak képződésének elősegítése
- Levegő
- olcsó, ezért gyakran használt
- ha a fehérje nem közel natív konformációjú, akkor félregombolyodott
állapotok keverékét kapjuk
- lassú
- diszulfidhídban nem résztvevő ciszteinek zavarnak
- Diszulfidcsere
- Redoxpuffer-rendszer, 5:1 vagy 10:1 arányban redukált és oxidált tiollal
- 1mM GSH és 0,2mM GSSG nagyon jó, de drága
- ciszteint, DTT-t, merkaptoetanolt, ciszteamint tartalmazó keverékek
- A tiolcsoportok védelme
- diszulfidhidas aggregátumok elkerülésére
- nagy koncentrációban oxidálószert adunk az oldathoz, minden tiolcsoport
vegyes diszulfidot képez
- így tisztítjuk, majd a végső fázisban tesszük redoxpufferbe
Ipari méretekben történő renaturáció
- A laboratóriumi eljárásból indulunk ki
- Elsősorban költségcsökkentés a cél: pufferek, reagensek, stb.
lecserélése olcsóbbra
- Eljárás egyszerűsítése, lépések sorrendjének megváltoztatása (kevesebb
puffercsere, stb.)
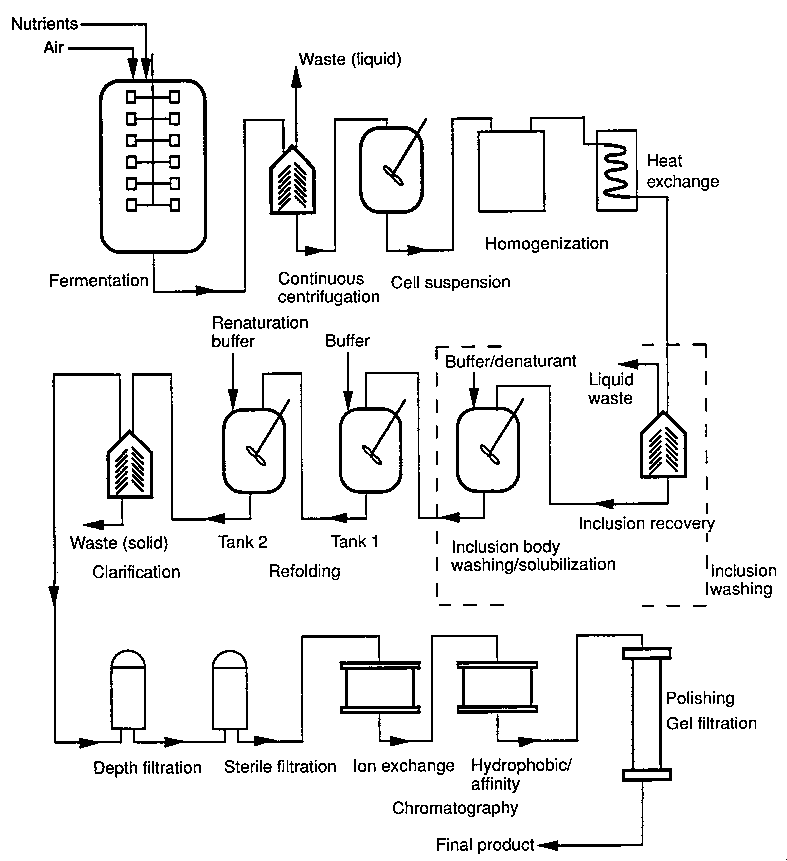 Fehérje nagyüzemi kinyerése E. coli inklúziós testből
Fehérje nagyüzemi kinyerése E. coli inklúziós testből
Az inklúziós test tulajdonságai igen kedvezőek a tisztítás szempontjából
(ellenálló, homogén, nagy sűrűségű, stb.)
De: Problémát okoz (az inklúziós testeket használó eljárás nem működik):
- Szekrécióval együtt poszttranszlációs módosítást igénylő fehérjék (pl.
eritropoetin glikozilálása)
- Nagy molekulatömegű (>30 kDa), többdoménes, 4 diszulfidhídnál többet
tartalmazó fehérjék
- Nagy molekulatömegű, heterooligomer fehérjék, pl. antitestek
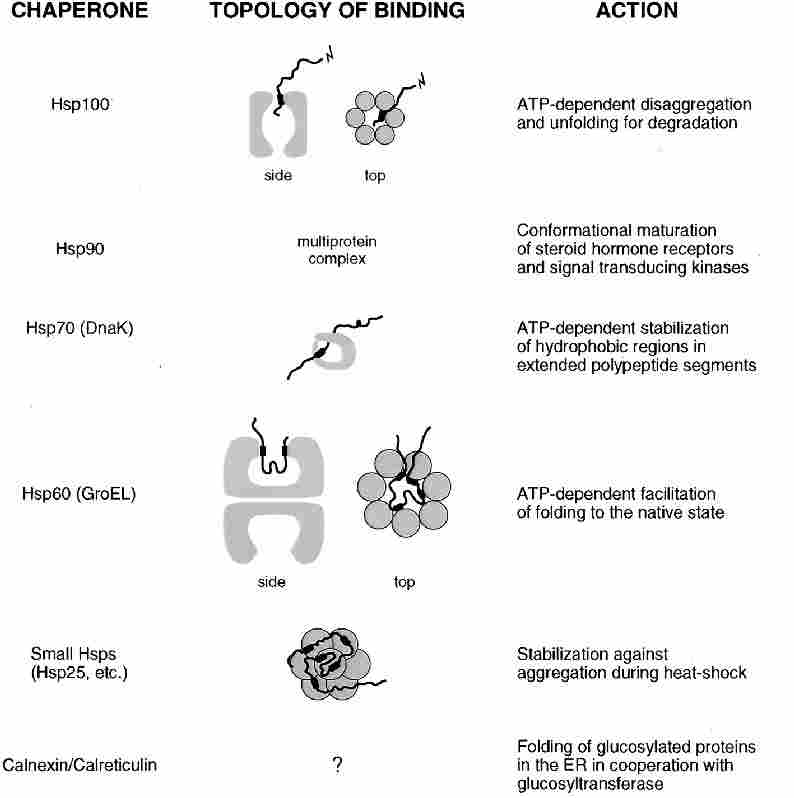













 Stratégiák inklúziós testek renaturálására
Stratégiák inklúziós testek renaturálására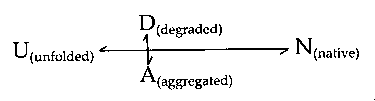
 Fehérje nagyüzemi kinyerése E. coli inklúziós testből
Fehérje nagyüzemi kinyerése E. coli inklúziós testből