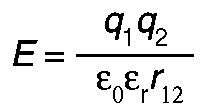A fehérjék szerkezete és az azt meghatározó
kölcsönhatások
1. A fehérjék szerepe az élőlényekben
2. A fehérjék szerkezetének szintjei
3. A fehérjék konformációs stabilitásáért felelős kölcsönhatások
4. Fehérjeadatbázisok
5. Szerkezeti családok
6. A fehérjék térszerkezetének meghatározása
A fehérjék szerepe az élőlényekben
Fehérjék csoportosítása biológiai feladataik alapján
| Típus és példa
| Előfordulás és funkció
|
Enzimek
|
| tripszin | bélben, proteolízis
|
| citokróm-c | elektrontranszport
|
| RNS-polimeráz | RNS-szintézis
|
Transzportfehérjék
|
| hemoglobin | oxigénszállítás
|
| szérumalbumin | zsírsavszállítás
|
Védőfehérjék
|
| ellenanyagok | immunválasz
|
| trombin | véralvadás
|
Toxinok
|
| diftériatoxin | baktérium mérge
|
Hormonok
|
| inzulin | glükózanyagcsere szab.
|
| növekedési hormon | csontok növekedése
|
Kontraktilis fehérjék
|
| miozin | izomműködés
|
| aktin | izomműködés
|
| dinein | csillók, ostorok
|
Struktúrfehérjék
|
| kollagén | kötőszövetek
|
| keratin | bőr, szőr, stb.
|
| glikoproteinek | sejthártya és sejtfal
|
Tartalékfehérjék
|
| ovalbumin | tojás
|
| kazein | tej
|
| ferritin | vastárolás a lépben
|
Fehérjék csoportosítása szerkezetük alapján
- Globuláris fehérjék
- Fibrilláris fehérjék
A fehérjék szerkezetének szintjei
- Elsődleges szerkezet
- Másodlagos szerkezet
- Topológiák (szupermásodlagos szerkezet)
- Harmadlagos szerkezet
- Negyedleges szerkezet
A fehérjék építőkövei: az aminosavak
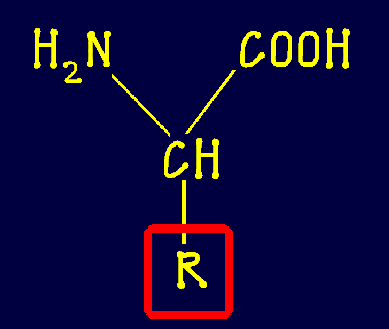
Az R oldallánc húszféle lehet:
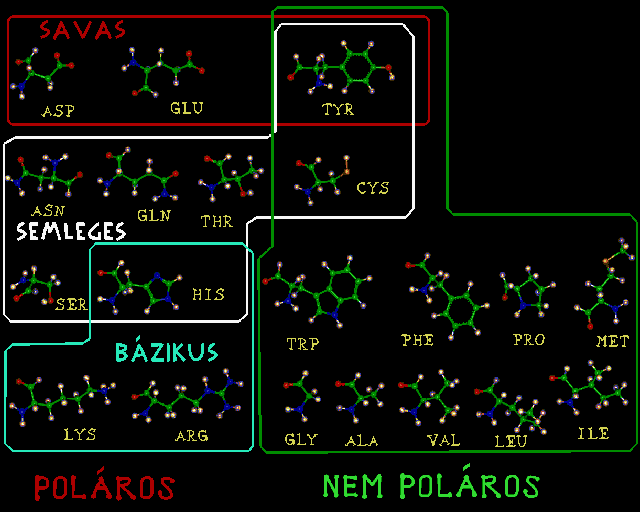

Az oldalláncok tulajdonságai
- A Gly növeli a főlánc flexibilitását
- Az elágazó oldalláncok merevebbek (Val, Ile, Leu)
- A Pro visszakapcsolódik a főláncba, ezzel merevít
- A Cys diszulfidhidakat képezhet
- A His pK-ja 6,0, lehet töltött vagy töltetlen,
gyakran vesz részt a katalízisben
Másodlagos szerkezet
A polipeptidlánc flexibilitása
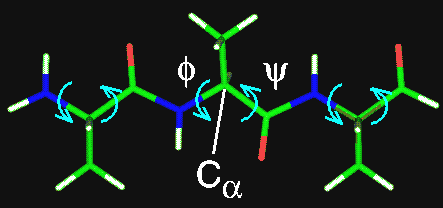
- A peptidkötés általában merev (részleges kettőskötés rezonancia miatt)
- cisz és transz állapotok lehetségesek, de a
transz állapot sokkal kedvezőbb energetikailag a cisz-nél.
- Kivéve a prolint, ahol a cisz állapot csak alig kedvezőtlenebb a
transz-nál, fehérjékben gyakran elő is fordul.
- Forgás az alfa-szénatom melletti két kötés körül lehetséges (fí, pszí
szögek)
- Az atomok kölcsönhatásai, ütközései
miatt az egyes (fi,pszi) párokhoz tartozó
konformációk nem azonos energiájúak. Ramachandran-térképen (Ala):
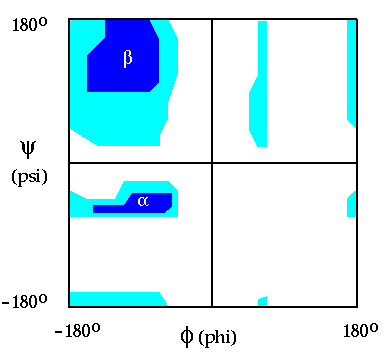
- Alfa-hélix és béta-redő energiaminimumai
- A Gly esetében a gerinc sokkal szabadabb, a Pro esetében pszi
értéke mindig -60 fok körüli.
Másodlagos szerkezeti elemek
- Másodlagos szerkezet: a lánc gerincének rövid távú szerkezete
- A polipeptidláncot szakaszokra bonthatjuk:
- Jellegzetes konformációk
- periodikus konformációk (homokonformációk; ugyanaz a (fi,pszi) pár
ismétlődik). Pl. hélixek, béta-redő.
- aperiodikus konformációk (heterokonformációk; a (fi,pszi) változik a
lánc mentén). Pl. béta-kanyarok, gamma-kanyar.
- Nem-jellegzetes konformációk (szabálytalan szerkezetek)
Hélixek
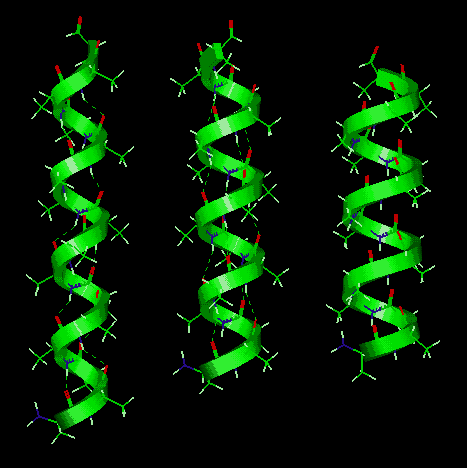

| 310 hélix
| Alfa-hélix
| Pi-hélix
|
- 310, menetenként 3 aminosavrész, egy H-kötés 10 atomot fog
közre
- i --> i+3 H-kötések (CO és NH között)
- túl szoros pakoltság, torzult H-kötések, ezért kedvezőtlen
- ritka, csak rövid szakaszok fordulnak elő, többnyire alfa-hélixek utolsó
fordulataként
|
- 3,613, menetenként 3,6 aminosavrész, két H-kötés 13 atomot
fog közre
- i --> i+4 H-kötések (CO és NH között)
- nagyon stabil, kedvező, ezért igen gyakori
- fehérjékben 4-30 aminosavrészből áll, átlagosan 11-ből (3 fordulat)
|
- 4,416, menetenként 4,4 aminosavrész, két H-kötés 16 atomot
fog közre
- i --> i+5 H-kötések (CO és NH között), de nagy a távolság
- számos ütközés, a hélix tengelyében lyuk van, ezért kedvezőtlen
- soha nem figyelték meg
|
- Az oldalláncok kifelé állnak.
- A peptidcsoportok mind ugyanúgy állnak, ezért a hélixnek makrodipólja van
- A fentiek mind jobbkezes hélixek. A balkezes energetikailag kedvezőtlen
az oldalláncok ütközései miatt, ezért nem fordul elő.
|
Amfipatikus alfa-hélix
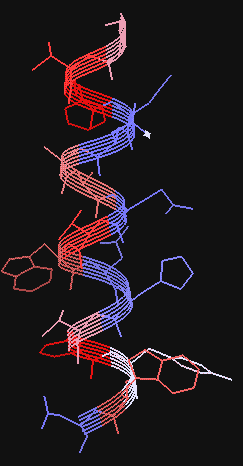
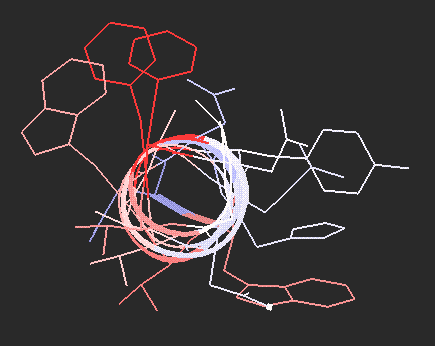
A hélixnek a fehérje belseje felé eső oldalán elsősorban apoláros, a víz
felé eső oldalán poláros oldalláncok vannak.
Egyéb hélixek
- Kollagénhélix: három párhuzamosan futó lánc, balkezes
hélixként egymásba fonódva.
- Poliprolin hélix
- Poliglicin
Béta-redő
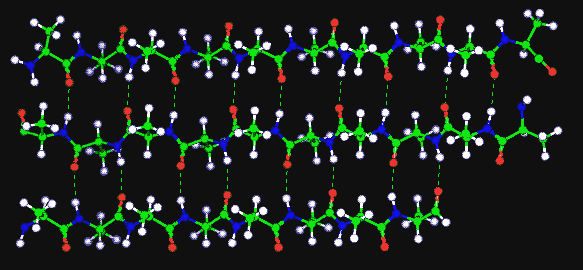
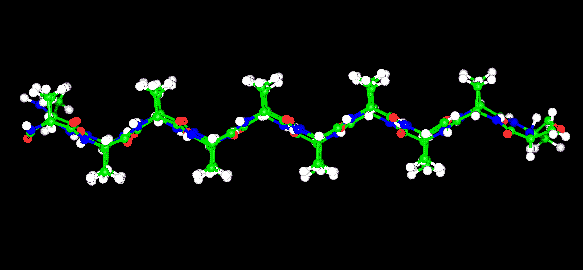
- Parallel vagy antiparallel módon futó szálak, közöttük
H-kötések.
- Az oldalláncok váltakozva lefelé és fölfelé állnak
- Igen gyakori a fehérjékben
- A legtöbb béta-lemezben balkezes csavar van, mert az egyes
szálak maguk is kissé csavarodnak.
- A béta-lemez méretének nincs határa. A selyemfibroin nagyon hosszú,
csavart béta-lemezekből áll.
Kanyarok (turnök)
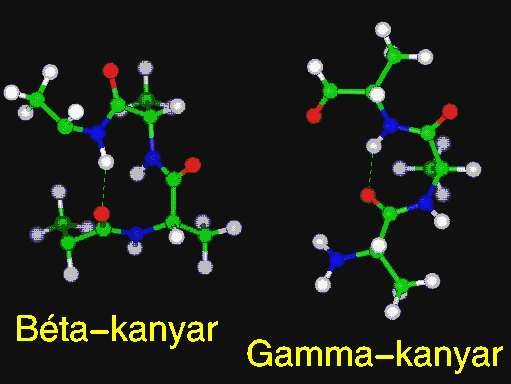
- Béta-kanyar: olyan, nemhelikális tetrapeptid, amelynél az első és
az utolsó alfa-szénatom távolsága 7 angströmnél kisebb.
- Gamma-kanyar: olyan tripeptid, melyben az első és az utolsó
peptidcsoport között hidrogénkötés van.
- Számos kanyartípust definiáltak a szögek alapján: 7-féle béta kanyar (+
háromnak a tükörképe is), 2-féle gamma-kanyar
Topológiák
A másodlagos szerkezeti elemek jellegzetes elrendeződései



- A béta-valami-béta motívumok általában jobbkezesek, mert a
polipeptidlánc gerince jobbfelé szívesebben csavarodik.
- 2 hélixből álló motívum a "coiled coil" (csavart csavar): két hosszú
hélix egymás köré csavarodva. Pl. keratin, tropomiozin.
Harmadlagos szerkezet
A teljes polipeptidlánc térbeli szerkezete, a másodlagos szerkezeti
elemek térbeli elrendeződése
Architektúrák: jellegzetes harmadlagos szerkezetek. Pl.:
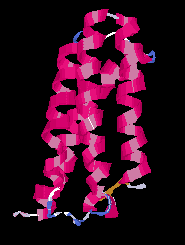
Hélixköteg (citokróm C)
| 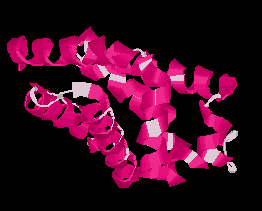
Hélixek (hemoglobin)
|
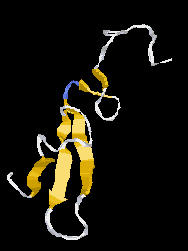
Egyszeres redő (heregulin alfa)
| 
Béta hordó (porin)
|
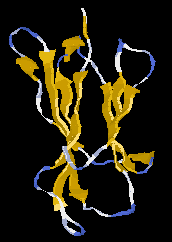
Béta szendvics (hisztokomp. antigén)
| 
Béta hasáb (agglutinin)
|
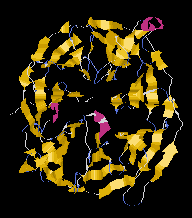
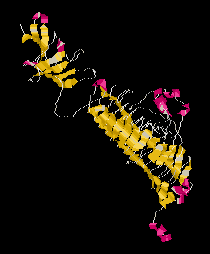
Béta propeller (metilamin dehidrogenáz)
| 
Béta szolenoid (Fágfeherje)
|
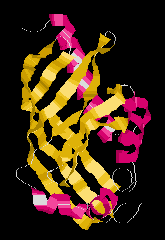
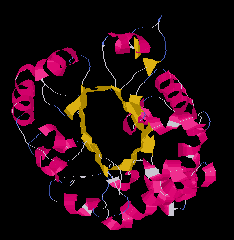
Alfa-Béta tekercs (scytalone dehidratáz)
| 
Alfa-Béta hordó (triózfoszfát izomeráz)
|

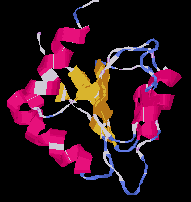
Alfa-Beta 2-szendvics (barnáz)
| 
Alfa-Béta 3-szendvics (génszabályozó fehérje)
|
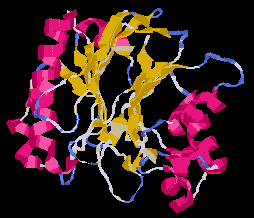
Alfa-Béta 4-szendvics (DNáz)
| 
Alfa-Béta Lópatkó (RNáz inhibitor)
|
Domének
- A polipeptidlánc globuláris régiói
- Feltehetően a felgombolyodás egységei
- A nagyobb fehérjék mind 100-150 aminosavnyi doménekre oszlanak
- Az egyes doméneknek gyakran más-más funkciója van
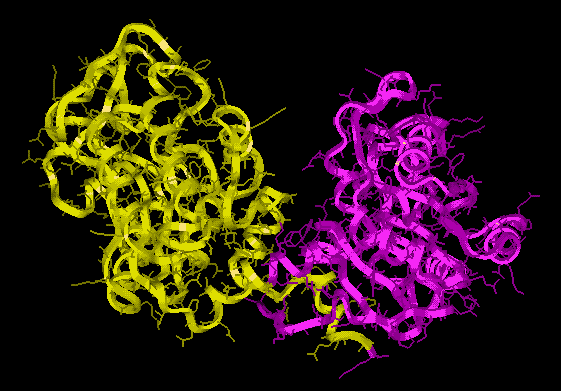
Foszfoglicerát kináz két doménje
Fold ("gomboly")
A gomboly (angolul fold) egy fehérjedomén globális, nagy vonalakban
vett szerkezete. Lényegében a polipeptidlánc gerincének hozzávetőleges
térbeli lefutását értjük alatta. Magában foglalja tehát a másodlagos
szerkezeti elemek egymáshoz viszonyított körülbelüli térbeli
elhelyezkedését, és az összeköttetéseik sorrendjét, a topológiát.
Az egymáshoz nagyjából hasonló térszerkezetű fehérjéknek tehát ugyanolyan
a "gombolyuk". Az azonos gombolyt mutató fehérjék egy szerkezeti családba
tartoznak.
Negyedleges szerkezet
A több polipeptidláncból álló fehérjék alegységszerkezete
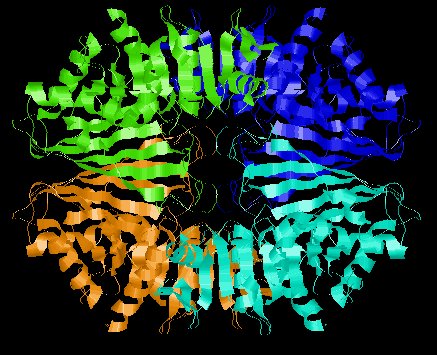
Gliceraldehid-3-foszfát dehidrogenáz
Koenzimek, prosztetikus csoportok
- Nem fehérje természetű molekulák, melyek a fehérjéhez kapcsolódnak
- Koenzim: könnyen disszociál
- Prosztetikus csoport: erősen kötődik a fehérjéhez
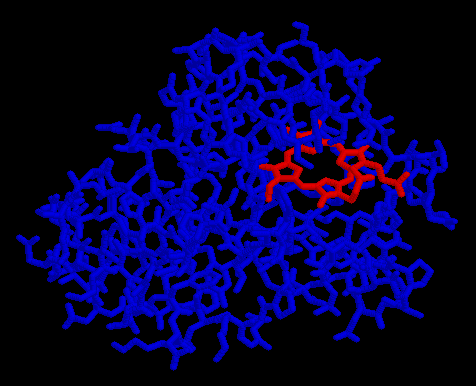
Mioglobin, benne hem csoporttal
Mag és felszín
- A fehérje belsejében az oldalláncok szorosan illeszkednek
- A térkitöltés sűrűsége: átlagosan 0,75 (mint egy jó kristály)
- A belső magban eltemetett oldalláncok többségében hidrofóbok, a
felszínen lévők polárosak vagy töltöttek
- A hidrofób oldalláncok 63%-a belül van, a maradék hidrogénkötött poláros
oldallánc.
- A töltött oldalláncok a felszín 27%-át teszik ki.
- Előfordulnak belső üregek, ha elég nagyok, víz is lehet bennük,
hidrogénkötötten.
A fehérjék konformációs stabilitásáért
felelős kölcsönhatások
- Rövid távú taszítás
- Van der Waals kölcsönhatás
- Elektrosztatikus kölcsönhatás
- Hidrogénkötés
- Hidrofób kölcsönhatás
- Diszulfidhidak
- Kooperativitás
Rövid távú taszítás
- Az elektronpályák taszítása miatt
- A távolság csökkenésével rohamosan nő az energia (szokás
1/r12-es függvénnyel közelíteni)
- Jó közelítéssel meghatározott sugarú, kemény gömböknek tekinthetjük az
atomokat. Sugaruk a Van der Waals-sugár.
Van der Waals-kölcsönhatás
- más néven London-erők vagy diszperziós erők
- bármely két atom között hatnak, az indukált dipólmomentumok
kölcsönhatása miatt
- távolságfüggése 1/r6-os
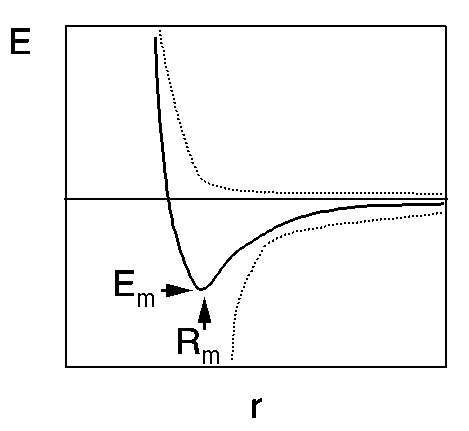
- A rövid távú taszítással összevonva adódik a Lennard-Jones
potenciál:
E = A/r12 - B/r6
Elektrosztatikus kölcsönhatás
A Coulomb-kölcsönhatás szerint:
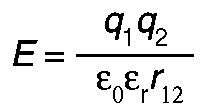
- A relatív dielektromos állandó a fehérje belsejében kb. 4, a vízben
kb. 80 (erős árnyékolás).
- Sóhidak (ionpárok): Lys, Arg és Glu, Asp között
- A peptidkötés dipólmomentumát hélix felerősíti
- A láncvégeken töltött amino-, ill. karboxilcsoportok
Vizes oldatban:
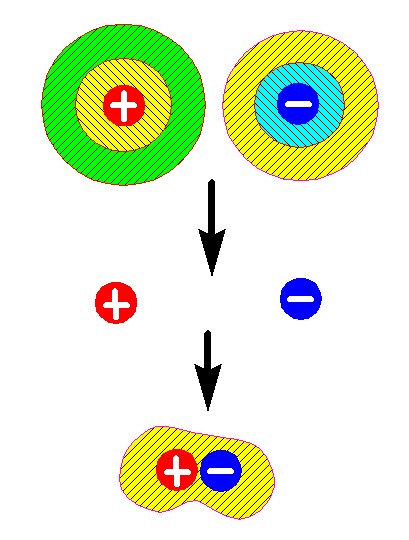
- A töltések körül nagyméretű hidrátburok van. Ha két ellentétes
előjelű töltést
közel akarunk vinni egymáshoz, hogy kialakuljon a Coulomb-kölcsönhatás, ahhoz
előbb le kell választani róluk a hidrátburkot (deszolvatáció), ami igen energiaigényes.
- A két töltés kölcsönhatásba lépésekor kedvező Coulomb-kölcsönhatás jön
létre, és egy kisebb hidrátburok. Ez az energianyereség nem
fedezi a hidrátburkok lefejtéséhez felhasznált energiát.
- Vizes oldatban tehát az elektrosztatikus kölcsönhatás energiája
általában kedvezőtlen!
- Fehérjében: Gyakran destabilizál (nem a stabilitásban, hanem a szerkezet
specificitásában van szerepe), de stabilizálhat, ha egyéb kölcsönhatások "rásegítenek", ill.
ha az ionpárok hálózatot képeznek.
- Magas hőmérsékleten: a hidrátburok jóval vékonyabb, lazább. A
deszolvatáció "olcsóbb" (kevésbé energiaigényes). A kölcsönhatás
energiája kedvező lehet. Termofil fehérjéknél gyakori.
Hidrogénkötések
- Nagy elektronegativitású atomhoz kapcsolódó hidrogének létesítik,
nagyrészt elektrosztatikus kölcsönhatás
- Típusai a fehérjékben:
| Donor-akceptor | Séma
|
|---|
| Hidroxil-hidroxil | -O-H...OH
|
| hidroxil-karbonil | -O-H...O=C<
|
| amid-karbonil | >N-H...O=C<
|
| amid-hidroxil | >N-H...OH
|
| amid - imidazol | >N-H...N<
|
| amid-kén | >N-H...S<
|
- Bifurkáció lehetséges (egyazon akceptor két donorhoz is köt)
- A proton az akceptort és a donort összekötö vonalon helyezkedik el, de a
két dipólus gyakran nem esik egy vonalba, így csökkent az energia.
Hidrofób kölcsönhatás
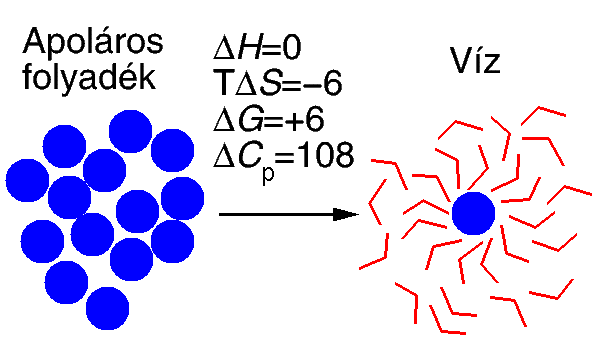
- Hidrofób molekulát szobahőmérsékleten apoláros folyadékból vízbe viszünk
át. Ekkor
- A víz kb. ugyanolyan energiájú kölcsönhatásokat létesít a hidratáció során, mint az apoláros
folyadékban a molekulák egymás közti VdW kölcsönhatásai -->
entalpiaváltozás kb. 0.
- A víz az apoláros molekula körül (mivel nem tud H-kötést képezni vele)
nagymértékben rendeződik, ketrec-szerű hidrogénkötött szerkezetbe. Emiatt jelentős
entrópiacsökkenés van.
- Ebből adódóan az átvitel szabadentalpiája nagy, tehát kedvezőtlen.
- A hőmérsékletet emelve az apoláros molekula körül rendeződött vizet ki
kell "olvasztani". Emiatt a hőkapacitás nagy.
- Az átvitelkor az entrópiacsökkenés arányos az apoláros molekula
felszínével.
- Az apoláros molekulák aggregálódásakor az apoláros felszín csökken,
a ketrec-szerű szerkezetbe rendeződött vízmolekulák nagy része felszabadulhat,
ami entrópianövekedéssel jár, ezért a folyamat kedvező. Ez a hidrofób
kölcsönhatás.
- Mivel az aggregáció entrópianövekedéssel jár, a hőmérséklet növelése
kedvez neki. A hőmérséklet növelésével a hidrofób kölcsönhatás
eleinte erősödik (szabadentalpiában mérve).
- A kölcsönhatás hőmérsékletfüggése bonyolult: A hőmérséklet emelésével az
entrópianyereség csökken (kb. 125 Celsius-fokon 0 lesz), az entalpikus
járulék (itt nem részletezendő okok miatt) viszont nő.
Ezért magas hőmérsékleten már csökken a hidrofób kölcsönhatás erőssége.
A kölcsönhatás maximuma kb. 75 Celsius-foknál lehet.
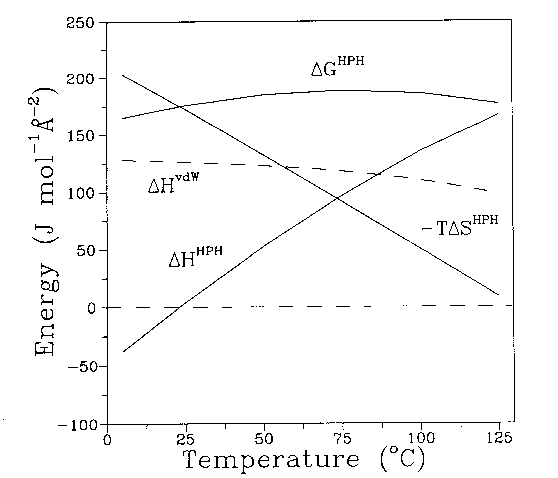
DeltaGHPH: szabadentalpia, a hidrofób kölcsönhatás erősségét
jellemzi
- Hidrofobicitási skálák: sokféle definíció a többféle mérési módszer
alapján
- Aminosav-oldalláncok hidrofobicitása: arányos az apoláros felszínük
nagyságával
Diszulfidhidak
Kooperativitás
- A fehérjemolekula konformációját eléggé gyenge kölcsönhatások
stabilizálják, de igen sok van belőlük
- A kölcsönhatások között kooperáció áll fenn: erősítik egymást,
ezért együttes hatásuk nagyobb, mint a külön-külön vett hatásaik összege.
- A konformációs stabilitás nagy számú stabilizáló és destabilizáló hatás
eredőjeként áll elő (nagy számok kis különbsége).
Fehérjeadatbázisok
- PDB: Protein Data Bank
- Az ismert térszerkezetek adatbázisa
- Mintegy 13 000 szerkezet (de ezek között csak kb. 1000 lényegesen különböző).
(Becslések szerint kb. 10 000 lényegesen különböző fehérjeszerkezet
létezhet az élővilágban.)
- SWISS-PROT
- Az ismert fehérjeszekvenciák adatbázisa
- Mintegy 90 000 szekvencia, és részletes leírások a fehérjékről.
- Egyéb: számos más adatbázis, pl. fehérjecsaládok, domének,
negyedleges szerkezetek, fehérjék génjei, szekvencia-összerendezések,
szerkezetek minőségellenőrzéseinek eredményei, termodinamikai paraméterek,
stb.
Szerkezeti családok
A fehérjék térszerkezetük alapján családokba sorolhatóak.
- SCOP
és CATH adatbázisok
- Hierarchikus felépítésűek
- SCOP hierarchia teteje: osztályok:
- Tisztán alfa fehérjék
- Tisztán béta
- Alfa és béta (a/b) (parallel béta, váltakozó alfa és béta régiók)
- Alfa és béta (a+b) (antiparallel béta, elkülönülő alfa és béta
régiók)
- Többdoménes fehérjék (domének más-más osztályban)
- Membrán- és sejtfelszíni fehérjék és peptidek
- Kis fehérjék (nagy része ligandum vagy prosztetikus csoport)
- "Coiled coil" fehérjék
- Kisfelbontású fehérjék
- Peptidek
- Tervezett fehérjék
- CATH:
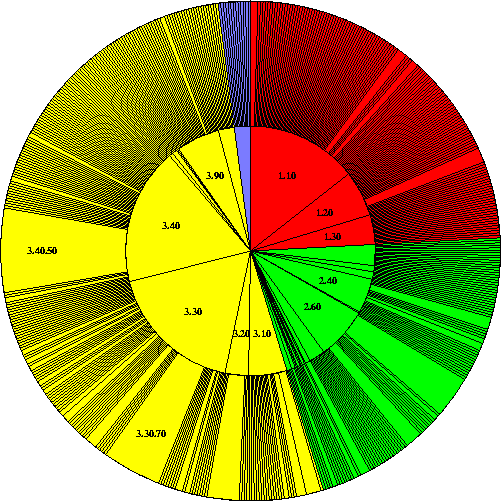
"CATH-kerék": a CATH adatbázisban lévô szerkezetek megoszlása a főbb
osztályok szerint
- Színek: piros: alfa, zöld: béta, sárga: alfa/béta, kék: nincs másodl. szerk.
- Belső kerék: architektúrák
- Külső kerék: topológiák
- A SCOP hierarchia további szintjei:
- Család: egyértelmű evolúciós rokonság
A szekvenciaazonosság a család tagjai között 30% vagy nagyobb, vagy pedig a
hasonló funkcióból és szerkezetből egyértelmű az evolúciós rokonság (akár
15% szekvenciaazonosság mellett is)
- Főcsalád (superfamily): Valószínűsíthető közös evolúciós
eredet
Alacsony szekvenciaazonosság, de a funkcionális és szerkezeti hasonlóságok
közös evolúciós eredetre utalnak
- Fold ("gomboly"): Jelentős szerkezeti hasonlóság
Lényegében ugyanolyan másodlagos szerkezeti elemek, ugyanolyan sorrendben,
ugyanolyan topológiával. A perifériális részek jelentősen eltérhetnek. Nem
feltétlenül közös eredet magyarázza a hasonló szerkezetet.
A szerkezet sokkal konzerváltabb, mint a szekvencia
- 30%-os szekvenciaazonosság a legtöbb esetben nagymértékű szerkezeti
hasonlóságra utal
- 10% alatti szekvenciaazonosság esetén is lehet lényegi hasonlóság két
szerkezet között
- 20-30% közötti szekvenciaazonosság: alkonyzóna. Lehet, hogy
hasonlítanak a szerkezetek, de lehet, hogy nem. Nehezen kezelhető.
A fehérjék szerkezetének meghatározása

A triózfoszfát izomeráz térszerkezete
A térszerkezet meghatározásának módszerei
- Röntgendiffrakció: kristályos állapotból, tetszőlegesen nagy méretű
fehérjékre. A hidrogéneket nem mutatja.
- NMR (mágneses magrezonancia): oldatban, csak kisméretű fehérjékre.
- Neutrondiffrakció (még nem elterjedt, de ígéretes)