A felgombolyodás problémája
1. A probléma
2. A fehérjék stabil konformációs állapotai
3. A felgombolyodás általános tulajdonságai
4. A felgombolyodás modelljei
5. A felgombolyodás nyomon követésének technikái
6. A felgombolyodás kinetikai jellemzői
7. Az "új szemlélet"
A felgombolyodási probléma
Centrális dogma:
DNS --> RNS --> polipeptidlánc ?-->? működőképes
konformáció
(genetikai kód második fele)
Anfinsen kísérlete (1961)
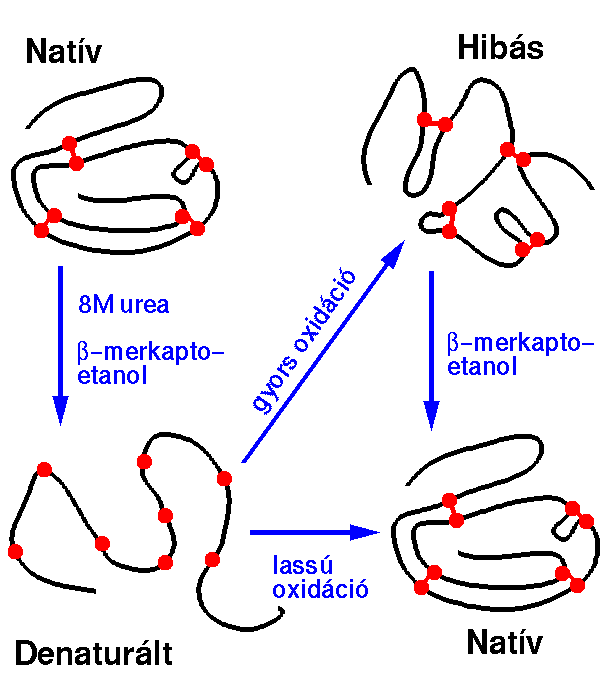
- Ribonukleáz enzim, benne 8 cisztein, 4 diszulfidhíd
- Diszulfidhidakat béta-merkapto-etanollal redukáljuk és a fehérjét 8M
ureával denaturáljuk --> rendezetlen szerkezet, hiányzó aktivitás
- Levegőn állni hagyjuk --> lassú oxidáció --> néhány óra alatt a
szerkezet helyreáll, az enzim aktívvá válik
- Oxidálószerrel gyors oxidáció --> diszulfidhidak rossz párosításban
állnak helyre --> sem a szerkezet, sem az aktivitás nem áll helyre
- Ez a hibás szerkezet kevés redukálószer hozzáadására kijavítódik
Következtetés: az aminosavsorrend tartalmazza a háromdimenziós
szerkezet kialakulásához szükséges összes információt. A felgombolyodás
termodinamikai kontroll alatt áll: a natív szerkezet a
termodinamikailag legstabilisabb állapot.
Tehát: az elsődleges szerkezet meghatározza a 3D szerkezetet. De
HOGYAN?
Ez a felgombolyodási probléma.
Alproblémák:
- Milyen kinetikus folyamat vagy útvonal révén veszi fel a fehérje a
natív, biológiailag aktív konformációt?
- Mi a felgombolyodott konformációk stabilitásának fizikai alapja?
- Az aminosavsorrend miért éppen azt a 3D szerkezetet és felgombolyodási
mechanizmust határozza meg, amit, és miért nem valami mást?
- Ha adott egy fehérje aminosavsorrendje, hogyan lehet abból a
háromdimenziós szerkezetet megjósolni?
Az első kérdés részkérdései:
- A felgombolyodás termodinamikai vagy kinetikai kontroll alatt áll?
Hogyan képes a polipeptidlánc rövid idő alatt megtalálni a natív szerkezetet?
- Mi indítja el a felgombolyodást, és mi az ehhez szükséges legrövidebb idő?
- Milyen útvonalon történik a felgombolyodás? Milyen a köztitermékek
szerkezete?
- Az in vitro kísérletek alapján felismert szabályszerűségek
érvényesek-e in vivo is?
A felgombolyodási probléma jelentősége
- Elméleti jelentőség: A molekuláris biológia és a fehérjebiofizika
egyik legizgalmasabb, legtöbb fejtörést okozó problémája. Számos
sejtbiológiai folyamattal nagyon szorosan összefügg.
- A genetikai kód második fele
- A fehérjék bioszintézise és degradációja
- Hősokk
- Biotechnológiai jelentőség:
- A baktériumban túlexpresszióval termeltetett idegen fehérjék
legtöbbször ún. inklúziós testekké tapadnak össze. Ezekből kell a
fehérjéket renaturálni.
- Orvosi jelentőség: "felgombolyodási betegségek": Mutáció hatására
vagy nem megfelelő körülmények között egyes fehérjék rosszul gombolyodnak
fel, aggregálódnak.
- Prionbetegségek: Amiloid lerakódások keletkezése szivacsos
agysorvadásban (kergemarhakór, Creutzfeld-Jakob)
- Amiloid rostok Alzheimer-kórban
A Levinthal-paradoxon: termodinamikai vagy kinetikai kontroll?
- Anfinsen kísérlete --> a natív térszerkezet a polipeptidlánc
szabadentalpia-minimumának felel meg, azaz termodinamikailag az a
legstabilabb állapot az adott körülmények között. Tehát a felgombolyodás
termodinamikai kontroll alatt áll.
- Hogyan találja meg a lánc az energiaminimumot?
- Minden peptidegységnek kb. 10 különböző konformációja van
- Tehát egy 100 aminosavból álló láncnak 10100 különböző
konformációja van.
- Egyik aminosavkonformáció a másikba legalább 10-13 másodperc
alatt alakul át, a teljes láncra vonatkoztatva 10-11 mp alatt.
- Tehát a natív konformáció megtalálásához kb. 1089 másodpercre,
azaz kb. 1081 évre van szükség.
- A valóságban 1 másodpercen belül felgombolyodik.
- A gyors felgombolyodás csak úgy lehetséges, ha a konformációs tér nem
férhető hozzá teljes egészében a lánc számára, hanem a folyamat egy
útvonalon halad, kinetikai kontroll alatt áll.
- Ez a Levinthal-paradoxon (Levinthal 1968): az Anfinsen-kísérlet
szerint termodinamikai kontroll van, az állapotszámlálás szerint kinetikai
kontroll. Most akkor melyik?
- A paradoxon feloldása: lásd később.
A fehérjék stabil konformációs állapotai
- A legombolyodott (denaturált) állapot. Jele: U (unfolded)
vagy D (denatured)
- A felgombolyodott (natív, általában biológiailag aktív)
állapot. Jele: F (folded) vagy N (natív).
- A köztes állapotok (köztitermékek, intermedierek). Jelük:
I (intermediate)
A legombolyodott (denaturált) állapot
- Ideális esetben: véletlen elrendeződésű lánc (random coil)
- minden torziós szög független a szekvenciában távolabbi torziós szögektől
- minden konformációnak kb. azonos a szabadentalpiája
- kivéve, ahol a lánc átfedné önmagát (kizárttérfogat-effektus)
- 100 aminosav --> 10100 konformáció. Ha egy oldatban 10 mg
fehérje van, ez kb. 1018 db molekula. Tehát: várhatóan mindegyik
molekula más-más konformációban van.
- Erős denaturálószerekben (6M GdmHCl, 8M urea) a fehérjék jó közelítéssel
valóban véletlen elrendeződésűek (hidrodinamikai tul. szerint)
- Enyhébb denaturálószerek, ill. pH- vagy hőmérsékleti szélsőségek: a
szerkezet kevésbé random, s valamivel kompaktabb.
- Lokális hidrofób oldallánc-csoportosulások
- egy kevés hélixtartalom (főleg alkoholos oldatban)
- Termodinamikailag a legombolyodott állapot egységes: nem tartalmazhat
kooperatívan felgombolyodott részstruktúrákat.
A teljesen felgombolyodott, natív állapot
- Alapegység a domén
- Számos esetben kimutatták, hogy az izolált domének önállóan képesek
felgombolyodni.
- Azonban az izolált domének többnyire nem olyan stabilak, mint a teljes
fehérje (pl. foszfoglicerát kináz)
- Az izolált doménekből általában nem rakódik össze a funkcióképes fehérje
- Szubdomének (doménnél kisebb töredékek): egyes esetekben szintén képesek
önálló felgombolyodásra, más esetekben nem.
- Doménméret felső határa kb. 200 aminosav. Ennél nagyobb feltehetően nem
gombolyodna fel.
- A szerkezet állandósága:
- A különböző kristályformákból röntgendiffrakcióval és az oldatból
NMR-rel nyert 3D szerkezetek lényegében mindig azonosak
- A szerkezet kisebb-nagyobb mértékben flexibilis (Brown-mozgás, kis
fehérjék néhány óránként vagy naponként teljesen le is gombolyodnak),
de közel marad az átlagszerkezethez.
A köztes állapotok
Másképpen: kompakt denaturált állapotok. Csak akkor
figyelhetők meg, ha elég sok molekula veszi fel ezeket, tehát ha eléggé
stabilak.
- Híg denaturálószerben vagy szerves oldószerben
- A leginkább vizsgált: "olvadt gombóc" (molten globule) állapot
- kompakt
- nagy konformációs fluktuációk, különösen az oldalláncoknál
- laza, nemspecifikus hidrofób kölcsönhatások
- rendezetlen, fluktuáló harmadlagos szerkezet
- ellenben a natívhoz hasonló másodlagos szerkezet
- számos fehérjében kimutatták (pl. alfa-laktalbumin, mioglobin)
- "Pre-olvadt-gombóc" (pre-molten-globule):
- kevésbé kompakt, sokkal lazább
- van másodlagos szerkezet, de nem mindig hasonlít a natívhoz
- néhány fehérjénél kimutatták (citokróm c, triptofán szintáz)
- "Nagy rendezettségű" olvadt gombóc:
- a natív harmadlagos szerkezet egy része megvan
- kevésbé fluktuál
- néhány fehérjénél találták (ubiquitin, antitest)
- Vitatott, hogy a köztes állapotok rajta vannak-e a felgombolyodás
útvonalán, vagy "útelágazások" eredményei.
A felgombolyodás általános tulajdonságai
- A natív állapot többnyire reverzibilisen legombolyítható:
- denaturálószer hozzáadásával
- melegítéssel vagy hűtéssel
- pH változtatásával (savanyítás, lúgosítás)
- nagy nyomással
- a diszulfidkötések elhasításával
- Kicsi, egydoménes fehérjék esetében többnyire:
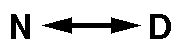
kétállapotú átmenet (N natív, D denaturált áll.)
A köztes állapotok ezeknél nem figyelhetőek meg. Kooperativitás
érvényesül: egy molekula vagy az N, vagy a D állapotban marad csak meg
tartósan, minden egyéb állapotból vagy az egyikbe, vagy a másikba ugrik.
- Más fehérjéknél köztes állapotok is fellépnek
- A populációk eloszlása a felgombolyodottság mértékének függvényében:
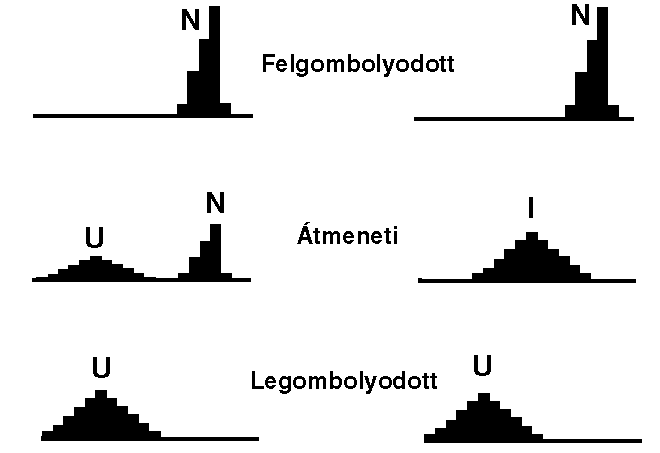
Bal oldal: egy kétállapotú, kooperatív átmenetet mutató fehérje
populációeloszlásai (kicsi, egydoménes fehérjékre jellemző)
Jobb oldal: köztes állapottal rendelkező, nemkooperatív úton
legombolyodó, hipotetikus fehérje populációeloszlásai
A felgombolyodott állapot stabilitása
Mennyiségek és értelmezésük
- Állandó nyomás és hőmérséklet: a rendszer egyensúlyi állapotát a
szabadentalpia (G) minimuma adja.
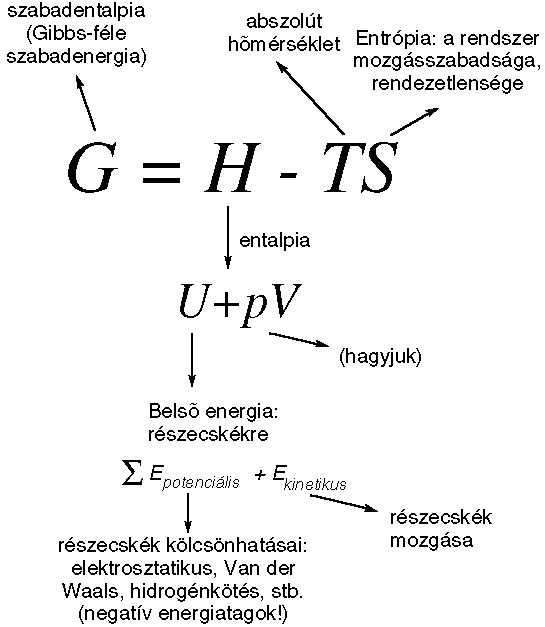
- Kedvező és ezért spontán módon végbemegy az a folyamat, melynek során
G csökken. Kedvezőtlen, ezért spontán módon nem megy végbe az a folyamat,
melynek során G növekedne.
| A folyamat jellege | G változása | H változása | S
változása | Értelmezés
|
| Kedvező | - | - | kicsi | Kölcsönhatások jönnek létre, melyek
csökkentik a belső energiát, ezáltal a szabadentalpiát
|
| - | kicsi | + | A rendszer mozgásszabadsága nő, így
növekszik az entrópia és ezzel a szabadentalpia
|
| Kedvezőtlen | + | + | kicsi | Kölcsönhatások szakadnak fel,
melyek növelik a belső energiát, ezáltal a szabadentalpiát
|
| + | kicsi | - | A rendszer mozgásszabadsága csökken, így csökken az
entrópia és ezzel a szabadentalpia
|
- Az entrópia és az entalpia általában egyirányba változik:
- Ha kölcsönhatások jönnek létre, az entalpia csökken, s a
mozgásszabadság csökken, így az entrópia is csökken
- Ha kölcsönhatások szakadnak fel, az entalpia nő, s a mozgásszabadság
nő, így az entrópia is nő
- Mi dönti el, hogy az entalpiacsökkentő vagy az entrópianövelő folyamat
valósul-e meg? A hőmérséklet, amely a szabadentalpia kifejezésében az
entrópiát súlyozza.
| Hőmérséklet | Kedvező folyamat | Hová törekszik a rendszer?
|
| Alacsony | Entalpiacsökkenés: kölcsönhatások kialakulása (emiatt
valószínűleg a mozgásszabadság csökkenése: entrópiacsökkenés) | Az alacsony entalpiájú állapotok felé
(melyekben a mozgásszabadság valószínűleg korlátozott, az entrópia alacsony)
|
| Magas | Entrópianövekedés: a mozgásszabadság növekedése (emiatt
valószínűleg kölcsönhatások felbomlása: entalpianövekedés) | A magas entrópiájú állapotok felé
(melyekben a kölcsönhatások valószínűleg felbomlanak, az entalpia magas)
|
- Példa: két állapottal rendelkező rendszer esetében:
- 1. állapot: alacsony entalpia, alacsony entrópia (pl. fehérje natív
állapota: sok kölcsönhatás, kicsi mozgásszabadság)
- 2. állapot: magas entalpia, magas entrópia (pl. fehérje denaturált
állapota: kevés kölcsönhatás, nagy mozgásszabadság [a lánc mozgásszabadságát
a konformációs entrópia jellemzi)
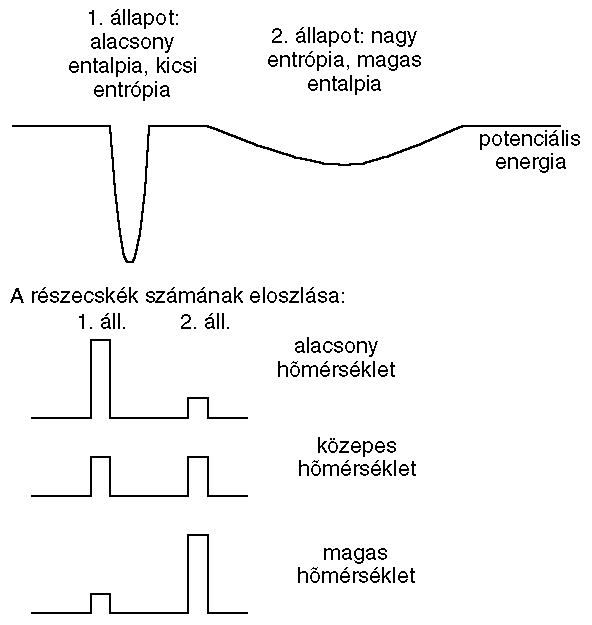
- A valóságban a helyzet bonyolultabb, mert denaturált állapotban az
apoláros oldalláncok körül a víz rendezett, alacsony entrópiájú, a
felgombolyodásnál ezek a vízmolekulák felszabadulnak, ami
entrópianövekedéssel jár. A konformációs entrópia csökkenése azonban
jelentősebb ennél.
A fehérjék termodinamikai paramétereinek hőmérsékletfüggése
A lizozim termodinamikai paraméterei:
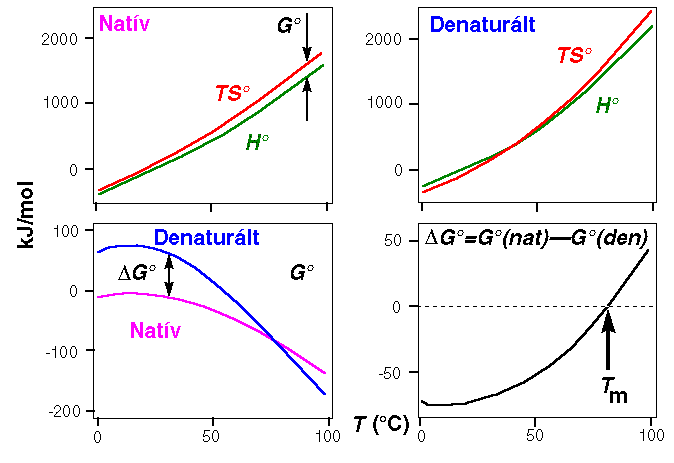
- A natív és a denaturált állapot közötti entalpia- és
entrópiakülönbség erősen hőmérsékletfüggő, mert a két állapot hőkapacitása
erősen eltér (a denaturálté sokkal nagyobb a nagyobb hidrofób felszín miatt)
- A natív állapot stabilitásának mértéke a natív és a denaturált állapot
közötti szabadentalpia-különbség (deltaG).
- deltaG egy parabolaszerű görbe, amely két helyen metszi a vízszintes
tengelyt:
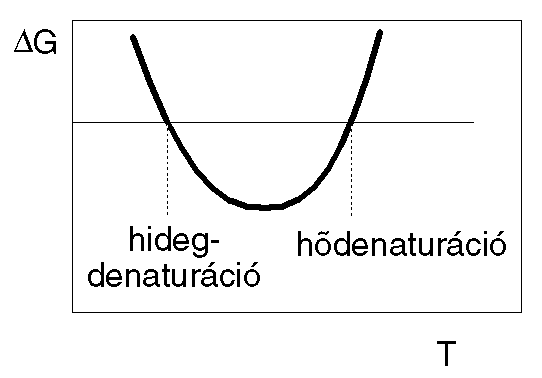
- deltaG-nek közepes hőmérsékleten van egy szélsőértéke. Itt maximális a
stabilitás
- Az egyik metszéspont a hődenaturáció hőmérséklete (olvadáspont,
Tm)
- A másik metszéspont a hidegdenaturáció hőmérséklete (gyakran 0 Celsius
alá esik)
- deltaG 5-15 kcal/mol (20-60 kJ/mol) közé esik, tehát a fehérjék
stabilitása kicsi. (Nagy számok kis különbsége)
- az N és U állapotok közötti egyensúlyi állandó
104-107 körüli.
A felgombolyodás kooperativitása
Mi az oka a kétállapotú átmenet kooperativitásának?
- A részlegesen felgombolyodott állapotokban olyan kedvezőtlen
kölcsönhatások lehetnek, amelyek sem a natív, sem a denaturált állapotban
nincsenek meg
- Az egyes kölcsönhatások kooperativitása
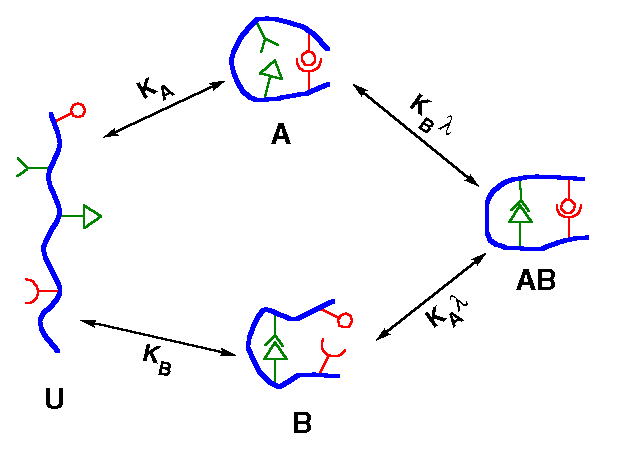
Két kölcsönhatás. Mindkettő erősíti a másikat egy lambda
kooperativitási faktorral. Ok: közelebb hozza a kölcsönható partnereket, így
kisebb lesz az entrópiaköltség.
Több kölcsönhatás esetén: Példa:
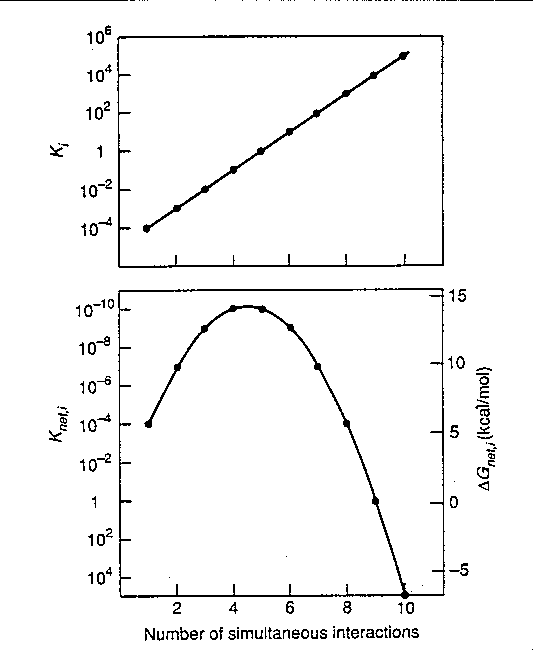
- 10 kölcsönhatás van, a legombolyodott állapotban mindegyikre
K=10-4
- A kooperativitás lambda=10 együtthatóval érvényesül
- Emiatt ha n kölcsönhatás már megvan, akkor az n+1.
K*lambdan egyensúlyi állandóval jön létre (felső
grafikon)
- Alsó grafikon: A legombolyodott állapot és az n kölcsönhatást
tartalmazó állapot közötti egyensúlyi állandó. Eleinte csökken, majd nőni
kezd. 10 kölcsönhatásnál az állapot stabilizálódik.
- Tehát sok gyenge kölcsönhatás a kooperativitás miatt stabilizálja egymást.
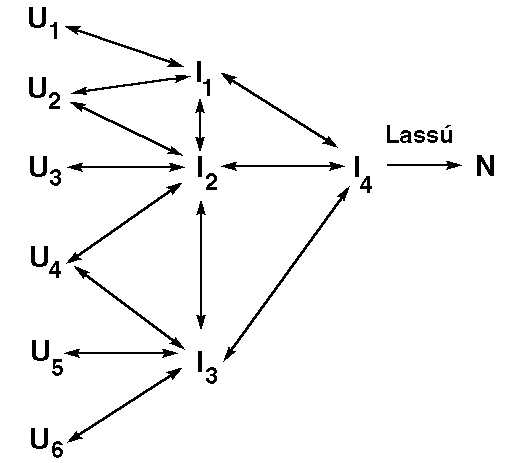
A felgombolyodás modelljei
- "Nukleáció és gyors növekedés" (Wetlaufer 1973)
A sebességmeghatározó lépés egy "folding mag" keletkezése. Ha ez megvan, a
felgombolyodás már erre építkezve gyorsan végbemegy. (Téves.)
Kinetikai séma:
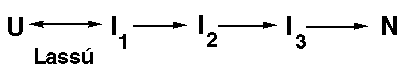
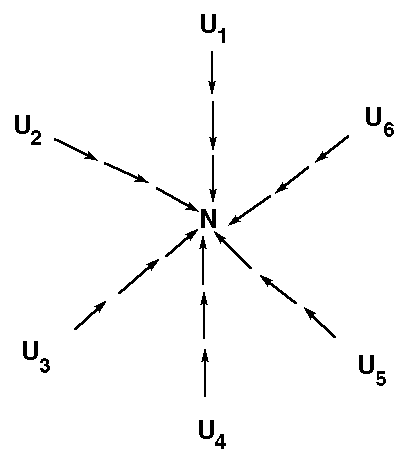
- "Puzzle játék" (jigsaw puzzle, Harrison és Durbin 1985)
Mivel a denaturált állapotban minden molekula konformációja más, mindegyik
más útvonalon gombolyodik fel. Ahogyan egy puzzle-t is sokféle sorrendben
lehet összerakni.
Kinetikai séma:
- "Diffúzió-kollízió-adhézió" (Karplus és Weaver 1976)
A legombolyodott fehérjében időnként natívszerű mikrodomének (pl.
hélixrészlet) jelennek meg, miközben a lánc részei diffúziós mozgást
végeznek. Ha a mikrodomének összetalálkoznak, összetapadnak és stabilizálják
egymást.
- Hierarchikus modellek:
Felgombolyodás a szerkezeti hierarchia szerint. Mag, másodlagos szerkezet,
szupermásodlagos, domén, monomer, oligomer.
- Moduláris modellek
Szubdomének mint modulok önállóan felgombolyodnak, majd asszociálódnak
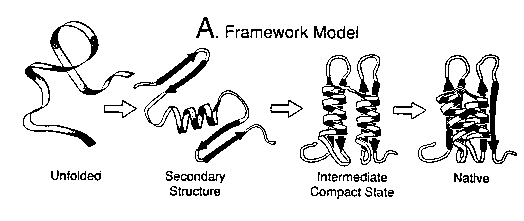
- "Keretmodell" (framework model, Baldwin 1989)
A másodlagos szerkezeti elemek korán létrejönnek (ez a felgombolyodás első
lépése) és meglehetősen stabilak. Később jön létre a harmadlagos szerkezet.
(Ez egy hierarchikus modell.)
- "Hidrofób kollapszus" (Dill 1985)
Az első lépés a lánc összeesése a hidrofób kölcsönhatás miatt. A másodlagos
szerkezet csak ezután vagy ezzel egyidőben jön létre.
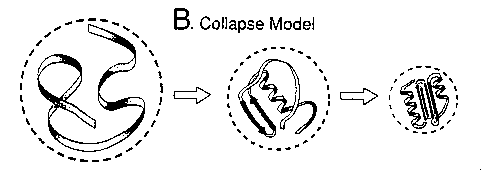
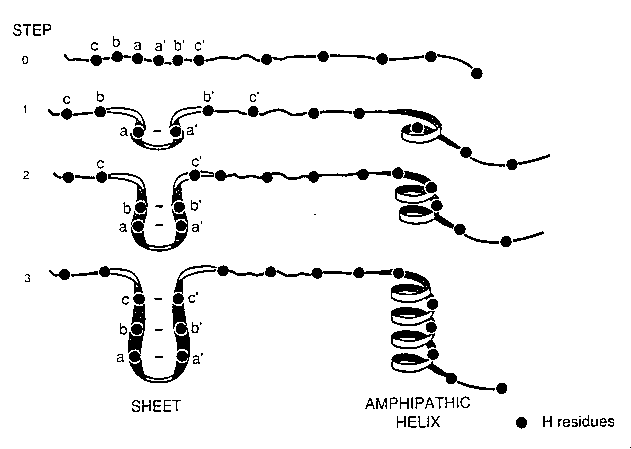
- "Hidrofób cipzár" (Dill 1993)
A hidrofób kölcsönhatás cipzárszerű viselkedése segíti a másodlagos
szerkezeti elemek létrejöttét.
A felgombolyodás nyomon követésének
technikái
Általánosan: a fehérjét denaturáló közegből gyorsan olyan környezetbe
visszük, amely a natív állapotnak kedvez. Pl.
- nemdenaturáló pufferrel kihigítjuk
- hidegdenaturált fehérjét hirtelen fölmelegítünk (T-ugrás)
- fotokémiai reakcióval indítunk
Ezután a felgombolyodás folyamatát követjük.
A felgombolyodás beindításának módszerei
- Keveréses módszerek
- Stopped-flow módszer (enzimkinetikából ismert)
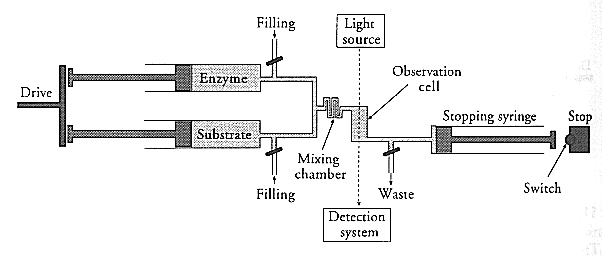
Itt a két hengerben nem szubsztrát és enzim, hanem fehérje és
nemdenaturáló puffer van. A dugattyúkat benyomjuk -->: gyors
összekeveredés. A megállító dugattyú ütközése állítja meg az áramlást és
indítja el a mérést.
Holtidő: kb. 1 ms.
- Turbulens keverők
Pl. Berger-féle golyós keverő.
Holtidő: >100 mikrosec vagy több
- Folyamatos áramlású rendszerek. Holtidő: pár 10 mikrosec.
- "freejet" (szabad sugaras) módszer: lamináris áramlás kis
nyíláson. Holtidő: pár 10 mikrosec.
- Nem keveréses módszerek
- Flash fotolízis: fotoreakció lézervillanással
- Fényindukált elektrontranszfer (redoxfehérjénél oxidált
denaturált állapotban elektrontranszfer felgombolyodást indít)
Holtidő: < 1 mikrosec
- T-ugrás, gyors fűtéssel
elektromos kisüléssel: holtidő 10 mikrosec
lézerrel: 20 nanosec!!!
A felgombolyodás követésének módszerei
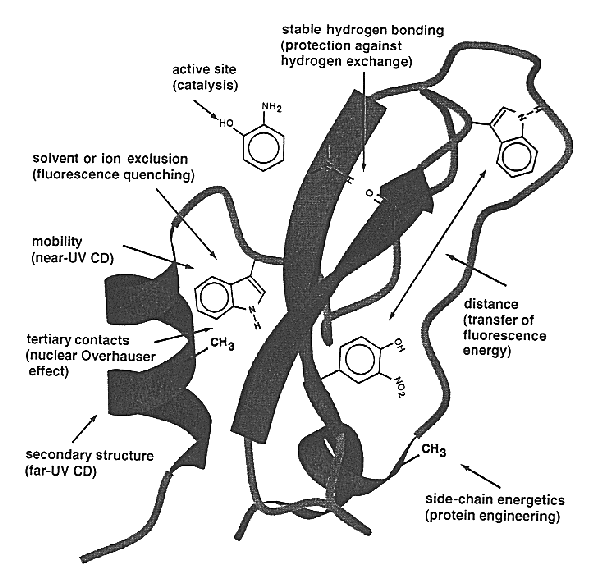
| Tulajdonság | Módszer | Felbontás | Mit mér?
|
| A hidrofób mag szorossága
| Belső fluoreszcencia | <1 ms | Főleg a triptofánok orientációja és
környezete
|
| Ultraibolya elnyelés | ms | Főleg a tirozinok orientációja és környezete
|
| Külső (ANS) fluoreszcencia | ms | Hidrofób foltok és árkok képződése,
felbomlása
|
| Fluoreszcencia quenching | ms | A triptofánok elszigeteltsége külső,
hidrofil quencherektől
|
| Ciszteinil quenching | 10 s | A ciszteinek védettsége hidrofil
reagensektől
|
| A molekula mérete
| Fluoreszcencia anizotrópiája | ms | A triptofánok mozgékonysága és kb.
molekulaméret
|
| Fluoreszcenciás energiatranszfer | ms | Triptofán és egy kovalensen
kapcsolt fluorofór távolsága
|
| Kisszögű röntgenszórás | <100 ms | Átlagos girációs sugár
|
| Kvázielasztikus fényszórás | 1 s | Átlagos girációs sugár
|
| Másodlagos szerkezet és tartós H-kötések
| Cirkuláris dikroizmus távoli UV-ben | ms | Szekvenciára és populációra
átlagolt gerinckonformáció
|
| "Pulse-labelling" NMR | 5-10 ms | Hol vannak stabil amid és triptofán
H-kötések
|
| "Pulse-labelling" tömegspektroszkópia | 5-10 ms | Hidrogénkötések
képződése diszkrét intermedierekben. Heterogén populációt felbontja!
|
| Harmadlagos szerkezeti kontaktusok, natív szerkezet megléte
| Biológiai aktivitás | ms-s | Natív szerkezet az aktív helyen
|
| Megszakított felgombolyodás | 10 ms | Diszkrét intermedierek
legombolyodási sebessége (mint stabilitásuk mértéke)
|
| CIrkuláris dikroizmus közeli UV-ben | ms | Stabil kontaktusok
aromás csoportok között, diszulfidhidak
|
| Valós idejű NMR | 1 s | Specifikus kontaktusok oldalláncok között
|
| Mutációs vizsgálatok | | Az egyes oldalláncok energiajáruléka a
diszkrét intermedierek stabilitásához
|
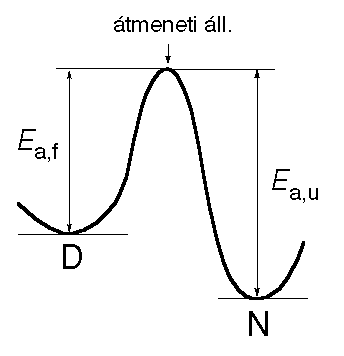
Az átmeneti állapotok jellemzése
- Átmeneti állapot: nagy energiájú, igen rövid élettartamú (ne keverjük
össze a köztes állapottal), állapot, két stabil állapot közötti energiagát
teteje.
- Jellemzése csak közvetett módszerekkel lehetséges:
Különféle tényezők hatását vizsgáljuk a felgombolyodás sebességére, ebből az
átmeneti állapot tulajdonságaira következtethetünk. Pl.:
- Hőmérséklet --> termodinamika, aktiválási energia
- Nyomás --> relatív moláris térfogat
- denaturálószerek --> vízzel érintkező felszínek
- ionerősség, pH --> ionizálható csoportok járulékai
- Ezekből általános kép: az átmeneti állapot kompakt, de laza konformációk
halmaza
A felgombolyodás kinetikai jellemzői
- Két állapot esetén a felgombolyodás "reakcióegyenlete":
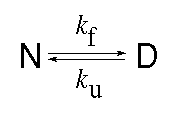
 kf a felgombolyodás, ku a
legombolyodás sebességi állandója.
A sebességi állandók kapcsolata az aktiválási energiákkal:
kf=Afe-Ea,f/RT,
ku=Aue-Ea,u/RT.
Az egyensúlyi állandó:
Keq=kf/ku
kf a felgombolyodás, ku a
legombolyodás sebességi állandója.
A sebességi állandók kapcsolata az aktiválási energiákkal:
kf=Afe-Ea,f/RT,
ku=Aue-Ea,u/RT.
Az egyensúlyi állandó:
Keq=kf/ku
A sebességi és egyensúlyi állandók tipikus hőmérsékletfüggése
(Arrhenius-ábrázolás és Van't Hoff-ábrázolás)
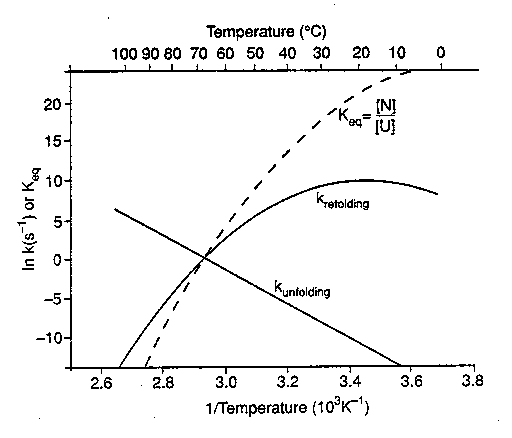
- Az ln K ábrázolva 1/T függvényében: Van't
Hoff-ábrázolás. Meredekségéből a reakció entalpiája (deltaH) számítható
ki.
- Az ln k ábrázolva 1/T függvényében:
Arrhenius-ábrázolás. Meredekségéből a reakció aktiválási energiája
számítható ki.
- A Keq Van't Hoff-ábrázolása kismértékben görbült, ez
deltaH hőmérsékletfüggéséből ered, ez pedig a natív és
denaturált állapot közötti hőkapacitás-különbségből. Utóbbi
abból adódik, hogy a felgombolyodás során hidrofób felszínek temetődnek el.
(A hőkapacitás ugyanis arányos a szabadon lévő hidrofób felszínek
összfelületével.)
- kf és ku Arrhenius-ábrázolásából az
átmeneti állapot milyenségére lehet következtetni:
- kunfolding (=ku) Arrhenius-ábrázolása lineáris -->
a legombolyodás aktiválási energiája hőmérsékletfüggetlen, tehát az átmeneti állapot
hőkapacitása megegyezik a natívéval. Ez azt jelenti, hogy az átmeneti állapotban
ugyanakkora hidrofób felszín van szabadon, mint a natív állapotban.
- krefolding (=kf) Arrhenius-ábrázolása erősen görbült -->
a felgombolyodás aktiválási energiája hőmérsékletfüggő, tehát az átmeneti állapot hőkapacitása
eltér a denaturáltétól. Ez azt jelenti, hogy a denaturált állapotból az
átmeneti állapotba kerülés során hidrofób felszínek temetődnek el.
- Konklúzió: az átmeneti állapot sokkal inkább a natív állapothoz
hasonlít, mint a denaturálthoz.
- (Csak véletlen, hogy a három görbe egy pontban metszi egymást)
Kinetikai modellek
- A legombolyodás kinetikája ált. egyszerű: két állapot, egy sima
sebességi állandó
- A felgombolyodás kinetikája ált. bonyolult
A felgombolyodás realisztikusabb sémája
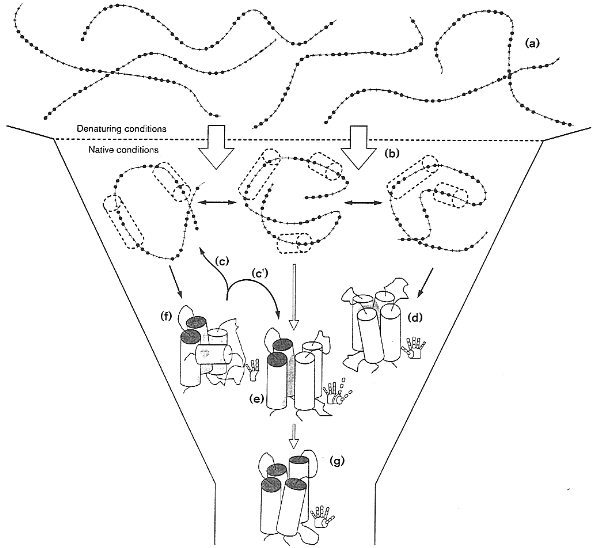
(a) legombolyodott molekulák
(b) hidrofób kollapszus, megjelenő másodlagos szerkezeti elemek, nukleációs
helyek
(g) a végcél: a natív fehérje, jobbkezes hélixköteg
(f) rossz konnektivitású konformáció
(d) rossz topológia: balkezes elrendeződés (hibás)
(e) megfelelő elrendeződésű, de még laza állapot
(c) a nem megfelelő köztitermék újból legombolyodhat
(c') vagy átrendeződhet.
Tölcsér: a folyamat során egyre csökken a hozzáférhető állapotok száma
(entrópia)
Az "új szemlélet"
- A kismolekuláknál megszokott reakciókinetika fogalmai nehézkesen
alkalmazhatóak a felgombolyodásra.
- Heterogén populációk vannak
- Nincs egyértelmű reakciókoordináta
Az új szemlélet kulcsfogalma: energiafelület
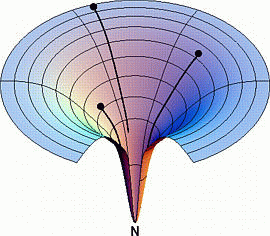
Felgombolyodási tölcsér
- Szabadentalpia-felület
- Függőleges tengely: a molekula ún. belső szabadentalpiája.
(az adott konformációhoz tartozó szabadentalpia, figyelembe véve az összes
lehetséges oldószer-konfigurációt). Tehát a molekula konformációs entrópiája
nincs benne.
- Vízszintes tengelyek: a fehérjéhez tartozó konformációs szabadsági fokok.
(Pl. az összes lehetséges torziós szög a fehérjében). Tehát a felület minden
egyes pontja a fehérje egy konformációjának felel meg.
- Sokdimenziós felület sokdimenziós hipertérben. A 3D ábrázolások csak
szemléltetések
- Az egyes molekulák a legmélyebb pontot keresik, minden molekula más-más
útvonalat bejárva, miközben a hőmozgás löködi őket. A felület globális
minimuma a fehérje natív állapotának felel meg, ide szánkáznak le a
molekulák a tölcsér oldalán.
A fenti sima felület a legegyszerűbb, kétállapotú rendszernek felel meg.
Általános eset:
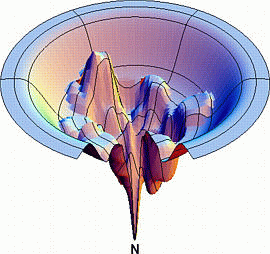
- bonyolult domborzat, dombok, gödrök, árkok, sok lokális minimum -->
bonyolult felgombolyodási kinetika
Két frakcióból álló sokaság a denaturált állapotban (lizozim ilyen):
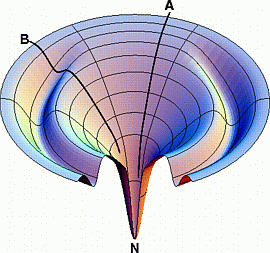
- lassan (B) és gyorsan (A) gombolyodó frakció
A Levinthal-paradoxon feloldása
Hibás kiindulópont:
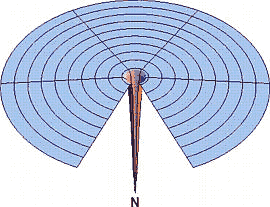
Levinthal javaslata: útvonalak:
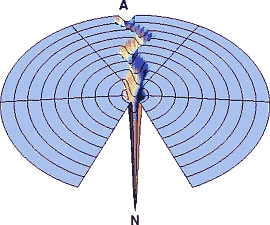
Valóság: tölcsér!
A felgombolyodás termodinamikai vagy kinetikai kontroll alatt áll?
Válasz: A natív szerkezet termodinamikai kontroll alatt áll (a
szabadentalpiafelület globális minimuma). Ezt az állapotot azonban a
felgombolyodás során kinetikus kontroll alatt álló intermediereken keresztül
éri el a fehérje.
Mindig a globális minimum-e a natív állapot?
Nem. Ellenpélda: plazminogén aktivátor inhibitor-1
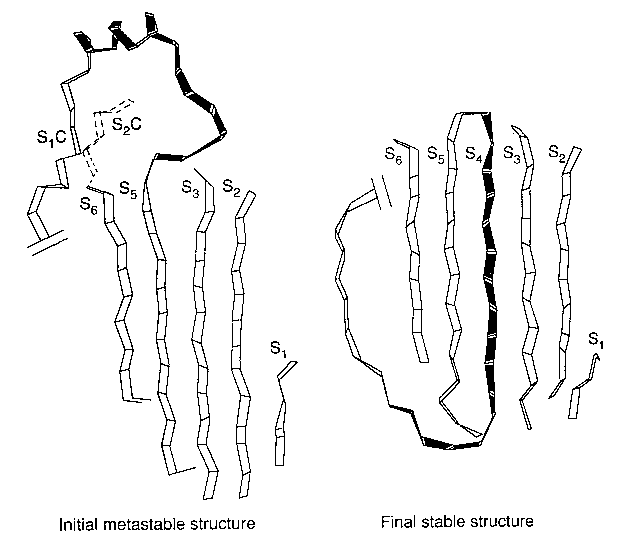
- A biológiailag aktív forma instabil, pár óra alatt átalakul egy stabilabb
állapotba
- Szerkezeti változás: a lánc egy része beépül a középső béta-lemezbe
- Energiafelülete efféle:
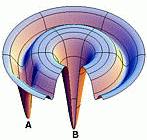
A régi és az új szemlélet összehasonlítása
| | Régi szemlélet
| Új szemlélet
|
| Színpad | Útvonal | Energiafelület (tölcsér)
|
| Szereplők | Jól elkülönülő, határozott szerkezetű, megjelölhető
állapotok (pl. N, D, I1, I2, stb.)
| A konformációk heterogén, dinamikus sokaságai
|
| Történés | Egymás után, meghatározott sorrendben történő események
sorozata | Sok párhuzamos szálon futó, diffúziószerű mikroszkopikus események
|
| Kísérleti háttér | Hagyományos, optikai jelek változásain alapuló
mérések | Modern módszerek (pulse-labelling NMR és tömegspektroszkópia,
mutációs vizsgálatok, gyors, lézerindítású mérések)
|
| Elméleti alap | Klasszikus kémiai reakciókinetika | Statisztikus
fizika: spinüveg-modellek és rácsmodellek
|




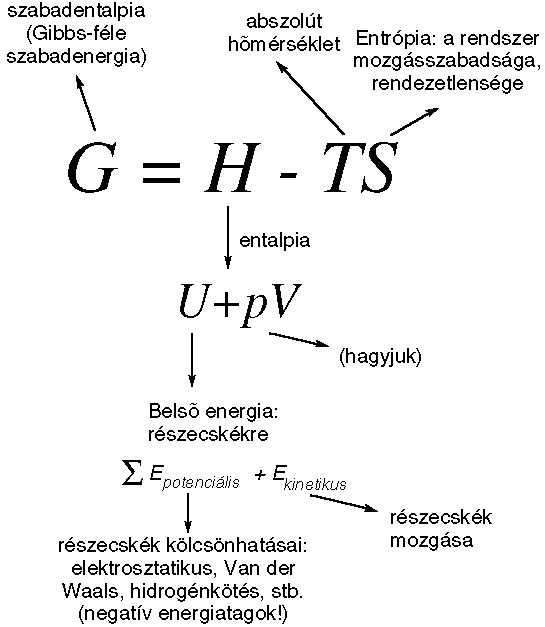





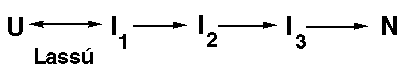


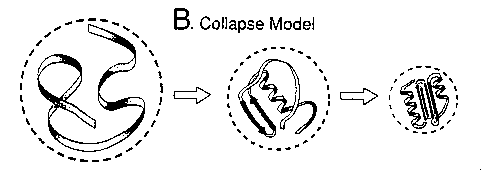



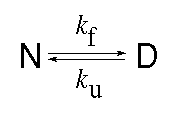
 kf a felgombolyodás, ku a
legombolyodás sebességi állandója.
A sebességi állandók kapcsolata az aktiválási energiákkal:
kf=Afe-Ea,f/RT,
ku=Aue-Ea,u/RT.
Az egyensúlyi állandó:
Keq=kf/ku
kf a felgombolyodás, ku a
legombolyodás sebességi állandója.
A sebességi állandók kapcsolata az aktiválási energiákkal:
kf=Afe-Ea,f/RT,
ku=Aue-Ea,u/RT.
Az egyensúlyi állandó:
Keq=kf/ku