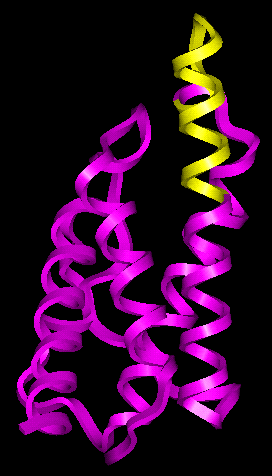"Olvadt gombócok" és más kompakt denaturált állapotok
1. Egy kis tudománytörténet
2. Az "olvadt gombóc" modell
3. Egyensúlyi köztitermékek
4. Kinetikus köztitermékek
5. Vitás kérdések
6. Az olvadt gombócok élettani szerepe
Egy kis tudománytörténet
- 70-es évek eleje: Oleg Ptitsyn megjósol egy állapotot, ahol a másodlagos
és harmadlagos szerkezetek már megvannak, de az oldalláncok nem illeszkednek
szorosan
- 1973-74 körül: első kísérleti jelek (szénsav anhidráz CD-spektruma)
- 1977: Kuwajima részletesebb vizsgálatai alfa-laktalbuminnal: a hélixek
előbb alakulnak ki, mint a szerkezet magasabb szintjei; úgy véli, a köztes
állapot nem kompakt
- 1978-tól: Ptitsyn és kutatócsoportja számos különféle módszerrel
vizsgálja az alfa-laktalbumin savindukált intermedierjét. Kimutatják, hogy
kompakt, de a hődenaturációja nem kooperatív, az oldalláncok szabadok:
olvadt, globuláris állapot.
- 1981: Ptitsynék fölfedezik az alfa-laktalbumin termikus intermedierjét
- 1982: Shakhnovich, Finkelstein: az olvadt gombóc állapot elméleti
modellje (folyadékállapothoz hasonlítja)
- 1983: Ohgushi és Wada bevezetik a "molten globule" (olvadt gombóc)
elnevezést
- 1984: Ptitsyn csoportja kimutatja a szénsav anhidráz kinetikus
intermedierjét, kimutatva, hogy ez fő tulajdonságaiban megegyezik az
egyensúlyi olvadt gombóccal
- 1987-től: a tudományos közösség kezdi elfogadni, hogy léteznek köztes
állapotok
- 1990-től: kételyek azt illetően, hogy az olvadt gombóc önálló
termodinamikai állapot-e
- 1993 körül: a kinetikus és egyensúlyi köztes állapotok összehasonlításai
- 1993-95-től: olvadt gombóc élettani szerepének vizsgálatai
- 1994-95: Pre-olvadt gombóc és nagy rendezettségű olvadt gombóc állapotok
felfedezése
- 1995-től: további kutatások: szerkezet, élettani szerep,
felgombolyodásban játszott szerep
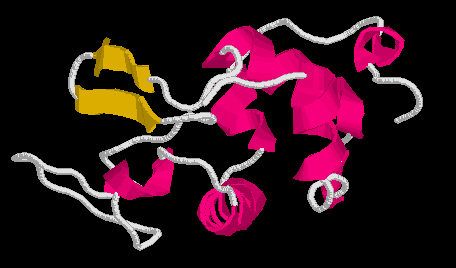
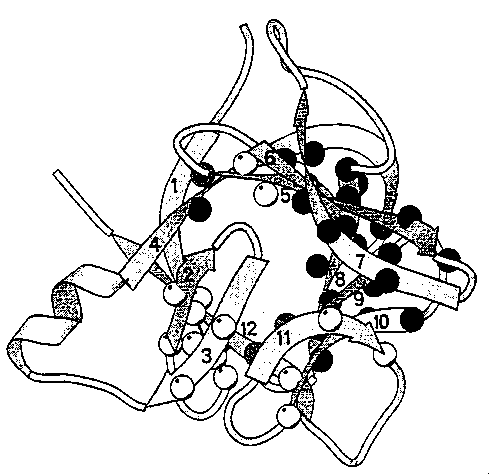
alfa-laktalbumin
Az "olvadt gombóc" modell
Ptitsyn (a keretmodell korai formája alapján) posztulálta olyan köztes
állapot létezését, amely
- globuláris formába kondenzálódott
- natívszerű másodlagos szerkezetet mutat
- nemspecifikus hidrofób kölcsönhatások stabilizálják, a hidrofób
oldalláncok főleg belül vannak
- topológiája közel van a natív szerkezetéhez
- "olvadt" jellegű, vagyis nincs merev harmadlagos szerkezete, az
oldalláncok nem illeszkednek szorosan, a teljesen legombolyodott állapotba
való átmenete nem kooperatív
Egyensúlyi köztitermékek
Híg denaturálószerben egyes fehérjék olyan, részlegesen denaturált állapotot
vesznek fel, amely
- Kondenzált, Stokes-sugara egyenlő a natív fehérjéével vagy csak kicsit
nagyobb
- jelentős másodlagos szerkezetet mutat (távoli UV CD mutatja), bár az ezt
stabilizáló H-kötések gyengék
- a legtöbb oldallánc szabad, nem képez harmadlagos kontaktusokat
- a molekula "ragadós": sok hidrofób oldallánc érintkezik a vízzel
- ha enzimről van szó, ebben az állapotban az nem aktív
- a legombolyodott állapotba való átmenet nem vagy kevéssé kooperatív
Kimutatás
Egyensúlyi denaturáció alapján
- Kétállapotú átmenetnek nem megfelelő görbe
- Különböző tulajdonságokat követve nem ugyanaz a középpont
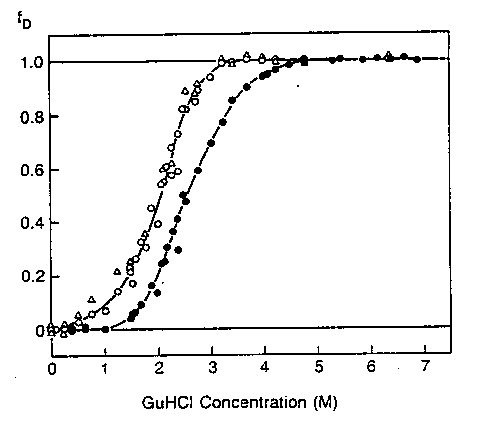
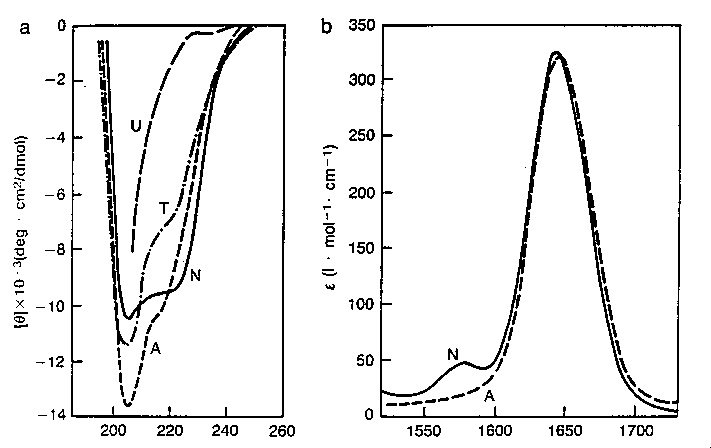
alfa-laktalbumin denaturációja,
közeli és távoli UV CD-vel nyomon követve

alfa1-antitripszin denaturációja, többféle
módon nyomon követve
Savas intermedierek
- CD-vel mért optikai tulajdonságaik hasonlóak a
denaturálószeres intermedieréhez, de
- nincs mellettük nagy hányadban natív vagy denaturált fehérje, ezért jól
vizsgálhatóak
- pl. szénsav anhidráznál, alfa-laktalbuminnál
Termikus intermedierek
- Több fehérjénél kimutatták, hogy a hődenaturált állapot nem teljesen
legombolyodott, hanem OG jellegű, jelentős másodlagos szerkezettel
- Denaturálószerrel újabb kooperatív átmenetre bírható
- Lehet, hogy a legtöbb fehérje ilyen
Kompaktság
A méretre, kompaktságra lehet következtetni:
- Viszkozitásméréssel
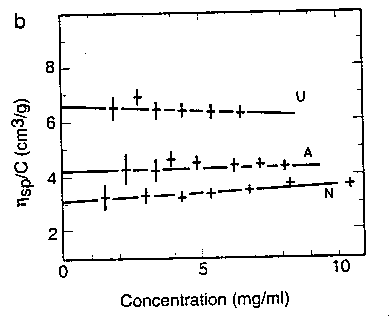
alfa-laktalbumin különböző állapotainak
viszkozitása
- Röntgenszórásból
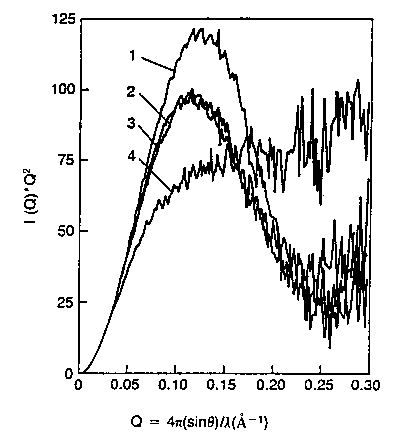
Citokróm c különféle állapotainak Kratky-plotja.
1: natív áll., 2,3: olvadt gombócok, 4: denaturált áll.
- Méretkizárásos kromatográfia (gélkromatográfia)
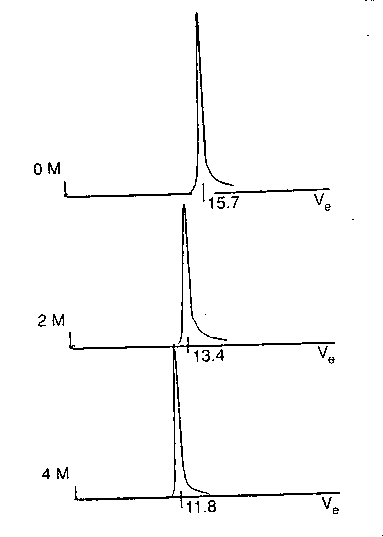
béta-laktamáz natív, olvadt gombóc és denaturált
állapotának elúciós profilja
- szedimentációs sebesség
- diffúziós együttható (fényszórásból vagy polarizációs interferometriával)
- urea gradiens gélelektroforézis
Következtetés: az olvadt gombóc mérete (sugara) mintegy 10-20%-kal
nagyobb a natív fehérjéénél
Másodlagos szerkezet
A másodlagos szerkezeti összetétel a távoli ultraibolya tartományban
végzett cirkuláris dikroizmus méréssel határozható meg.
Harmadlagos szerkezet
Oldalláncok környezete, mozgási szabadsága
Nagyléptékű fluktuációk
- Hidrogénkicserélődés sebessége nő
- Proteázokra való fogékonyság nő
Nagyban megnövekedett fluktuációkra utal
Hidrofób felületek
Vegyületek, melyek hidrofób felületekhez kötődnek:
- ANS (8-anilino-naftalin-1-szulfonát): kötődéskor nagymértékben megnő a
fluoreszcenciája.
Natív állapotban a szabad hidrofób foltokhoz kötődik. Az olvadt gombócokhoz
nagymértékben kötődik

- 3-trifluorometil-3-m-[125I]jódfenil-diazirin és
[3H]diazofluorén (DAF): fotoaktiválható hidrofób reagensek.
Nagymértékben kötődnek az olvadt gombócokhoz
Az olvadt gombócoknak nagy hidrofób felületük miatt a
membránokhoz is nagy az affinitásuk
Topológia
- Olvadt gombócról röntgenszerkezet nincs, NMR-spektrumok értelmezése nehéz
- pH-ugrásos hidrogénkicserélődéses kísérlet:
- Savas olvadt gombóc állapotban nehézvízbe téve a fehérjét
különféle időtartamokig hagyjuk menni a kicserélődést
- A pH-t hirtelen megnöveljük, a fehérje natívvá válik
- NMR-rel meghatározzuk a kicseréletlen protonok helyét
Eredmények:
- A védettségi tényezők sokkal kisebbek, mint a natív állapotban
(108 helyett 100-1000 körüliek)
- Egyes régiók védettséget mutatnak:
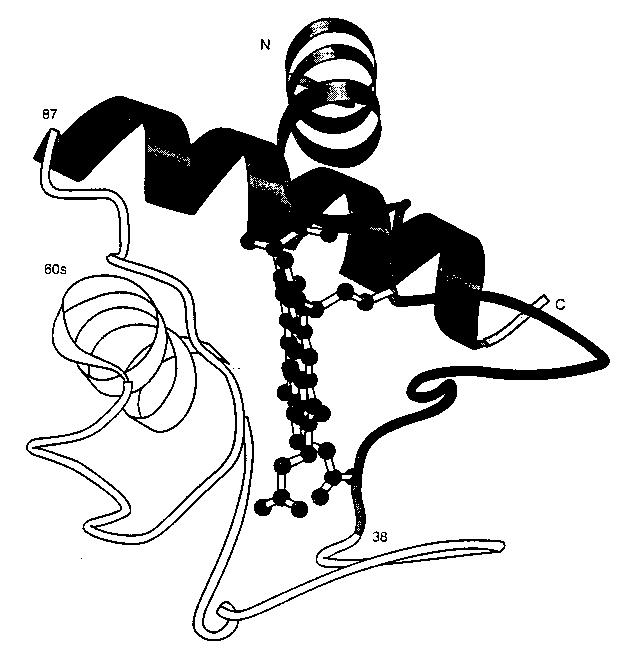
Citokróm c, az OG állapotban védett régiók
satírozva
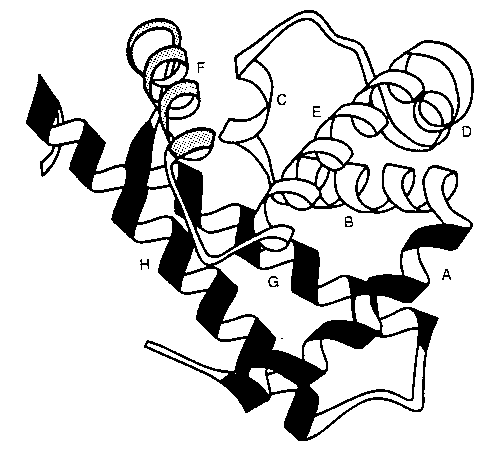
Mioglobin, az OG állapotban védett régiók
satírozva
- Olyan régiók mutatnak védettséget, amelyek a natív szerkezetben
klasztereket képeznek --> feltehetően az OG-ben is
- A távoli UV CD spektrumok nagyon hasonlóak --> a védettséget nem mutató
hélixeknek is meg kell lenniük, csak azok erősen fluktuálnak
Natívszerű-e a harmadlagos szerkezet?
- Deszpentapeptid-inzulin (egy öt aminosavnyi szakaszt töröltek az
inzulinból):
OG állapotának kétdimenziós NMR vizsgálatát elvégezték. Következtetések:
- Megvannak a hélixek és a béta-szálak
- Egymáshoz képest nagyjából úgy helyezkednek el, mint a natív szerkezetben
- De erősen fluktuálnak (egymáshoz képest)
- Diszulfidhidas kísérletek: a diszulfidhidakat felbontva ugyanúgy
képződnek-e újra az OG állapotban, ahogy a natívban kell?
- alfa-laktalbumin: sokféle diszulfidvariáció
- béta doménjétől megfosztott alfa-laktalbumin: dominánsan natívszerű
diszulfidképződés
- ellentmondó eredmények, vélemények
Fehérjék víz-alkohol keverékben
- Számos fehérje OG tulajdonságokat mutat víz-alkohol keverékben
- Jelentős másodlagos szerkezet
- Némelykor ott is hélixek vannak, ahol a natív szerkezetben nem (az
alkohol helicitást indukál)
- Óvatosan kezelendők az eredmények, mert nem tudni, mennyire esik egybe
az alkoholos OG 3D szerkezete a klasszikus OG-ével
Pre-"olvadt gombóc" állapot
- béta-laktamáz egyensúlyi denaturációjában 4 Celsius-fokon két
intermediert találtak
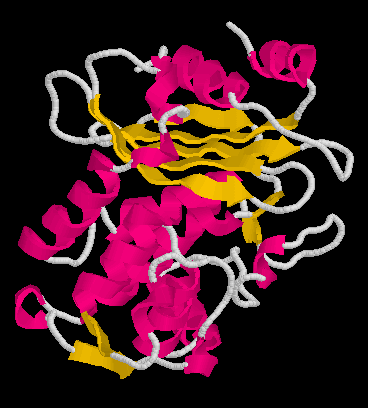
béta-laktamáz
- az egyik a szokásos OG
- a másik egy lazább szerkezet:
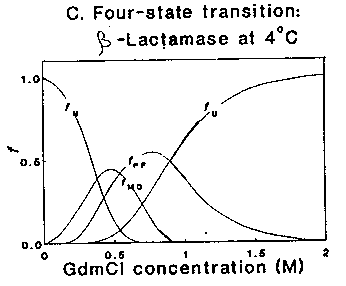
béta-laktamáz különféle állapotainak
részarányai a denaturálószer-koncentráció függvényében
- jelentős másodlagos szerkezet, de nem annyi, mint az OG
- kompakt, de nem annyira, mint az OG
- köti az ANS-t, de nem annyira, mint az OG
- hasonlót találtak szénsav anhidráznál
- felgombolyodásban korai intermedier lehet?
Nagy rendezettségű olvadt gombóc állapot
- Interleukin-4 savas állapota: CD és ANS-kötés szerint OG
- NMR-spektroszkópiából számolt rendezettségi paraméterek szerint csak az
egyik hélix vége lazult fel, a hidrofób mag nagy része megmaradt:
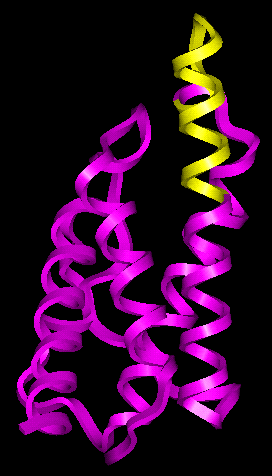
Interleukin-4, a fellazult rész sárgával
- Több más fehérjénél kimutattak hasonlót (lólizozim, Staphylococcus
nukleáz, apocitokrómok)
- Felvetették, hogy a felgombolyodásban késői intermedier lehet
- De: amely fehérjéknél ezt kimutatták, azoknál hagyományos OG állapotot
nem találtak --> ez talán csak egy másfajta OG
Kinetikus intermedierek
- Felgombolyítási kísérletek leggyakoribb eredménye: a távoli UV CD gyorsan
kialakul, az aromás oldalláncok környezete és az enzimaktivitás jóval
lassabban.
- Tehát: másodlagos szerkezettel rendelkező intermedier halmozódik fel (I)
- Az I a felgombolyodásban a fő energiagátat, a sebességmeghatározó lépést
előzi meg:
U --(gyors)--> I --(lassú)--> N
Az I intermedierről kiderült, hogy
- Kondenzálódott (kompakt)
- másodlagos szerkezete van
- kevés benne a kialakult harmadlagos kölcsönhatás
- "ragadós"
- ha enzimfehérjéről van szó, akkor inaktív
- ideiglenesen létezik, a felgombolyodás sebességmeghatározó lépése előtt
Vagyis: nagymértékben hasonlít az egyensúlyi OG-hoz (tranziens vagy
kinetikus OG). Egyes esetekben azonban vannak eltérések.
Kompaktság
- Viszkozitásmérés, ureagradiens-elektroforézis, méretkizárásos
kromatográfia --> az I állapot kompakt, Stokes-sugara 10-15%-kal nagyobb
a natív állapoténál
- Ureagradiens-gélelektroforézis:
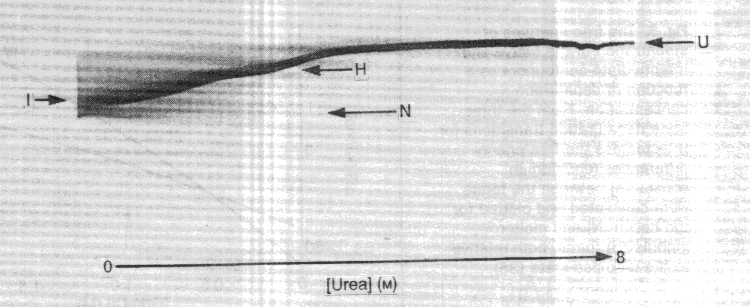
béta-laktamáz stabil OG állapotát vitték a gélre
(H). U: legombolyodott, N: natív, I: kinetikus intermedier
- Méretkizárásos kromatográfia:
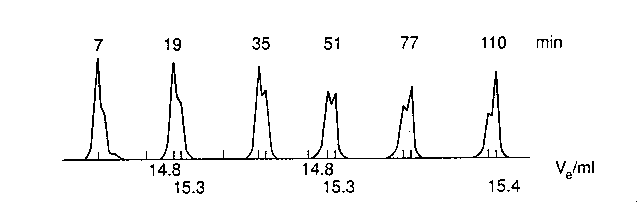
béta-laktamáz stabil OG állapotát natív pufferbe helyezve
alacsony hőmérsékleten elindították a felgombolyododást, majd időnként
kromatogramot vettek fel. A stabil OG állapot 13,4 ml-nél jönne le, ez nem
jelenik meg, csak a 14,8-nál lejövő I és lassan a 15,3-nál lejövő N.
- Béta-laktamáznál és szénsav anhidráznál jól megkülönböztethető az I a
stabil OG-tól. Kissé kompaktabb.
Másodlagos szerkezet
- Stopped-flow CD-mérések --> natív másodlagos szerk. nagy része
ms-os időskálán kialakul
- Alfa-laktalbumin: a stabil OG és az I távoli UV CD-spektruma azonosnak
adódott
- Interleukin 1-béta (béta-fehérje):
- Összefoglalva: nagyon hasonló a stabil OG-hez
Harmadlagos szerkezet
Oldalláncok környezete és mozgékonysága
- NMR-spektrumok: gyakorlatilag megegyeznek az egyensúlyi OG-ével
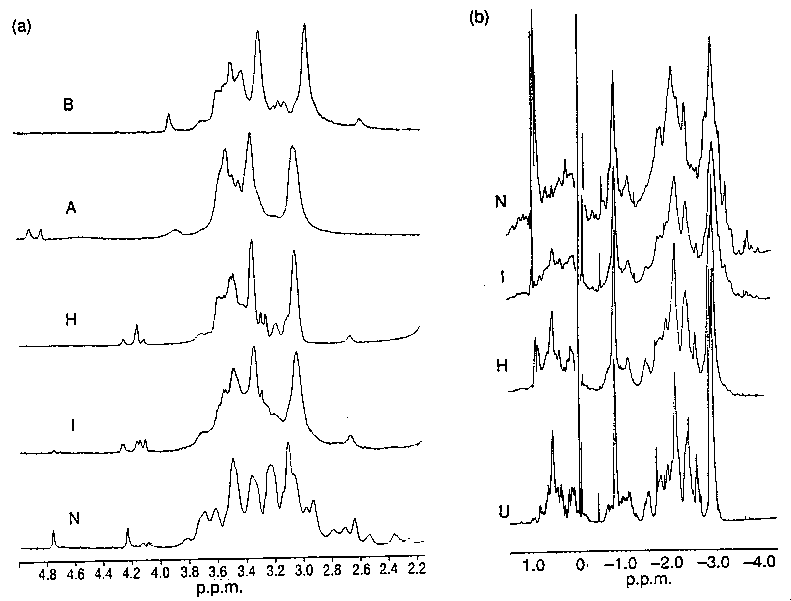
béta-laktamáz különböző állapotainak
NMR-spektrumai. (a) aromás régió, (b) alifás régió
- közeli UV CD: ugyanez
Hidrofób felületek
- ANS-fluoreszcencia követése stopped-flow felgombolyításnál
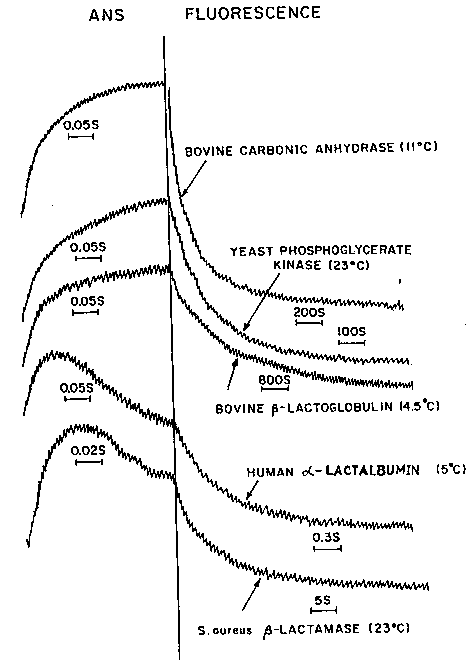
Öt
fehérje ANS-fluoreszcenciájának változása a felgombolyodás során (közben
időskála-váltás)
- ANS-kötés előbb gyorsan nő, majd lassan csökken
Topológia
- Pulse labelling hidrogénkicserélődéses kísérletek szerint a kinetikus OG
nagyon hasonló az egyensúlyi OG-hoz (citokróm c, apomioglobin)
- Irányított mutagenezissel végzett kísérletek ugyanezt adják
A "hirtelen megugrási" (burst) intermedier
- A felgombolyodás során néhány ms-en belül ("burst", megugrási
szakasz) képződik egy intermedier, jelentős másodlagos szerkezettel
(a natív 50-100%-a)
- ANS-kötésnek is van ugyanilyen gyors fázisú szakasza
- citokróm c hem csoportjának kioltása egy triptofán által, szintén a
burst fázisban, arra utal, hogy a kompaktizálódás is bekövetkezik
- --> a "burst" intermedier is OG jellegű, de inkább a pre-OG-re
hasonlít. Pre-OG a burst intermedier egyensúlyi megfelelője?
Vitás kérdések
Natívszerű-e az olvadt gombóc?
- Hagyományos olvadtgombóc-modell (à la Ptitsyn):
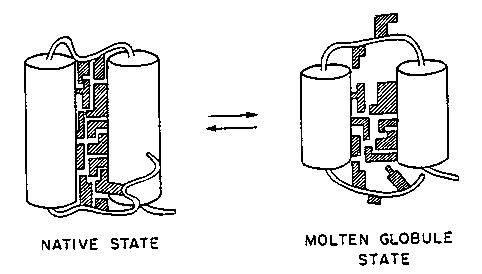
- Lényegében megvan a lánc natív topológiája, csak az oldalláncok szoros
illeszkedése hiányzik
- A szerkezetnek két szintje van: a lánc nagybani alakja és az
oldalláncok pontos illeszkedése a harmadlagos szerkezetben
- Alternatív álláspont: nincs meg a natív topológia
- Privalov 1997: Nem jó az olvadtgombóc-modell, mert
- Termodinamikai mérések alapján állítható, hogy ami olvadt gombócnak
látszik, az vagy rosszul felgombolyodott (nem natív topológiájú) fehérje,
vagy pedig egy része (domén v. szubdomén) felgombolyodott, többi része
rendezetlen
- Ha már megvan az egész natív topológia, akkor az oldalláncoknak nagyon
gyorsan össze kéne pakolódni
- Creighton: a legtöbb olvadt gombócot meglévő natív diszulfidhidak
mellett állították elő. Ha ezeket felbontjuk, nemigen alakul ki natív
szerkezet
- Dill: Elméleti modellek alapján: nem lehet, hogy az oldalláncok erősen
mozognak, a gerinc meg nem; a kettő szorosan csatolt
- Újabb cikkek: az aggregátumok könnyen összetéveszthetőek OG állapottal
A Ptitsyn-modell mellett talán több kísérleti bizonyíték szól, de egyre
többen hajlanak a Privalov-féle nézetre is. Úgy tűnik, sokféle olvadt gombóc
van, nem olyan egyszerű a helyzet, mint korábban gondolták.
A felgombolyodás intermedierjei rajta vannak-e a
felgombolyodás útvonalán, vagy kívül esnek rajta?
- A kinetikai kísérletek eredményeit többnyire jól lehet illeszteni az
U=I=N (on-pathway) és I=U=N (off-pathway) modellre is
- On-pathway: I nagyobb koncentrációja gyorsítja a felgombolyodást
- Off-pathway: lassítja
- mindkettőre vannak példák
Az olvadt gombócok élettani szerepe
Fehérjetranszport membránon át
- Két szakasz: (1) a fehérje hozzátapad a membránhoz, (2) más fehérjék
révén egy ATP-függő mechanizmus átviszi
- Kimutatták: hozzátapadás gyorsabb, ha OG állapotban adjuk a fehérjét
- Hozzátapadt állapotban érzékenyebb a proteázokra
- Számos fehérjénél, pl. mitokondriumba irányuló transzport
Membránba fűződés
- Pl. toxinok, melyek a sejtmembránba ágyazódnak, áteresztővé téve azt.
Ilyen a kolicin A:
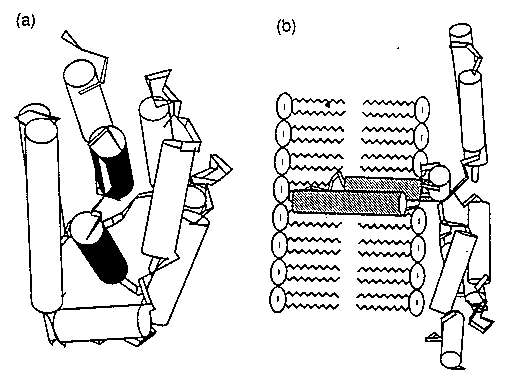
(a) a kolicin natív szerkezete, (b) a membránba
ágyazódott szerkezete (valószínűsíthető)
- A belső két, hidrofób hélix kifordul.
- Kimutatták, hogy a kolicinnak van savas OG állapota, ez indukálódhat a
membrán közelében, megkönnyítve az átalakulást. (A membrán felszínén
töltések vannak, ezért ennek közelében a citoplazma pH-ja, ionerőssége eltérhet a
távolabbi régiók pH-jától.)
- Sok más, hasonló fehérjénél
Kötődés chaperonokhoz
- Chaperonok részlegesen felgombolyodott fehérjét kötnek, számos kísérlet
szerint valamiféle OG vagy pre-OG jellegű állapotot.
- Alfa-laktalbumin kötődik a GroEL chaperoninhoz, az OG-nél valamivel kevésbé
kompakt állapotban
Egyéb
- Többalegységes fehérjék összeszerelődésénél (monomerek OG-ben lehetnek)
- Apoláros ligandumok szállítása: membrán közelében a fehérje OG-vé válik,
és lelöki magáról az apoláros ligandumot
- Receptor-ligandum kapcsolódás: némi mozgékonyság kell hozzá
- Emésztődés a lizoszómában, savas környezetben
- Ubiquitinfüggő folyamatok (pl. degradáció): az ubiquitin (egy 76
aminosavból álló, kis fehérje) kovalens kötődése a fehérjéhez OG állapotba
viheti a fehérjét, ezáltal előkészíti lebontásra a proteaszóma (a sejt
fehérjelebontó gépezete) számára