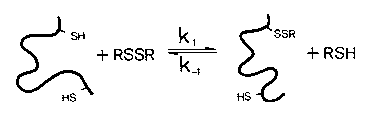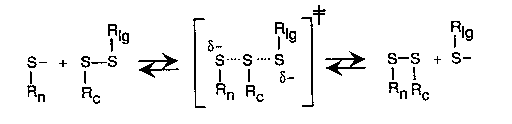Prolinizomerizáció. A diszulfidhidak képződése.
- Prolinizomerizáció
- A prolin cisz és transz állapota
- A prolinizomerizációs hipotézis
- A prolinizomerizáció próbái
- Mutációs kísérletek
- Nagyobb fehérjék
- A prolinizomerizáció katalízise in vivo
- A diszulfidhidak képződése
- A diszulfidhidak kémiája
- Diszulfidreagensek
- A felgombolyodás elemzése diszulfidhidas
intermedierek révén
- Az intermedierek csapdába ejtése
- A csapdába ejtett intermedierek jellemzése
- Diszulfidhidak révén feltérképezett felgombolyodási útvonalak
- A kinetikus intermedierek szerepének és fontosságának
meghatározása
- Protein diszulfid izomeráz
Prolinizomerizáció
- Felgombolyodás kinetikája ált. többfázisú
- gyors fázis: 1 ms - 1 s
- lassú fázis: 10 s - 1000 s
- A lassú fázis adja az amplitúdó nagy részét pl.:
RNáz A, RNáz T1, tioredoxin, triptofán szintáz
- A gyors fázis dominál, de lassú is van:
lizozim, Staphylococcus nukleáz, citokróm c, ubiquitin, BPTI, barnáz
- A lassú fázisok hátterében gyakran prolinizomerizáció áll.
A prolin cisz és transz állapota
- A peptidkötés lehet transz (omega=180 fok) v. cisz
(omega=0 fok)
- Nem Pro aminosavak: cisz állapot nagyon kedvezőtlen, ezért az egyensúlyi
állandó [transz]/[cisz] értéke 100-1000 körüli
- Pro-nál:
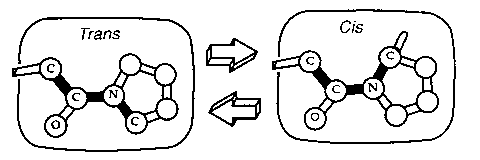
nincs akkora eltérés, ezért az egyensúlyi áll. kb.
[cisz]/[transz] = 0,4
azaz kb. 30% cisz, 70% transz.
- Pro-izomereket csak NMR-rel lehet kimutatni, optikailag nem.
- Kis peptideken vizsgálták, izomerizáció lassú (300 s időállandó körül)
- Fehérjékben: a natív szerkezetben a Pro-k meghatározott izomerizációs
állapotban vannak
- Cisz-Pro-t tartalmazó fehérjéknél a felgombolyodás lassú fázisa dominál
A prolinizomerizációs hipotézis
Brandts, Halvorson és Brennan 1975:
- A natív állapotban mindegyik prolinnak meghatározott izomerizációs
állapotban kell lennie
- A legombolyodott állapotban mindegyik prolin a 0,4-es egyensúlyi állandó
szerint viselkedik, ezért sok nemnatív izomer van
- Azok a legombolyodott molekulák, amelyekben mindegyik Pro a natívnak
megfelelő izomerizációs állapotban van, gyorsan felgombolyodnak, a többiek
lassan
Újabb kiegészítés: Natívszerű állapotban is lehetnek nemnatív
Pro-izomerek (sőt, ált. ilyenek vannak)
A prolinizomerizáció próbái
A kettősugrási próbák
(double-jump assays)
Kettős ugrás: ugrások a denaturálószer-koncentrációban. Két változat:
- Lassan felgombolyodó denaturált formák kimutatására:
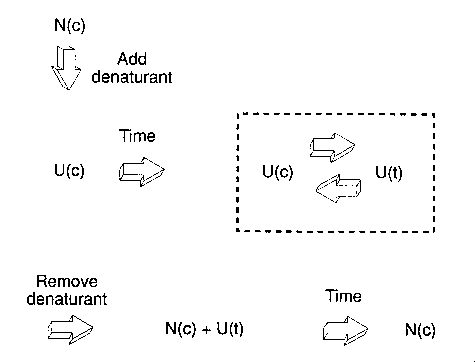
(Tegyük fel: a natív formában 1 db cisz-Pro van.)
- Natív állapotot (N(c)) tömény denaturálószerrel denaturáljuk (1. ugrás)
- Adott t inkubációs ideig hagyjuk a cisz és transz állapotok
egyensúlyát beállni a legombolyodott állapotban (U(c) <--> U(t))
- Ekkor kihigítással eltávolítjuk a denaturálószert (2. ugrás)
- Mérjük a natív állapot elérését; a lassú fázis amplitúdója arányos lesz
az inkubálási idő alatt keletkezett U(t) (lassan gombolyodó forma)
mennyiségével
- Ábrázolás: lassú fázis amplitúdója az inkubációs idő függvényében
- Tipikus eredmény:
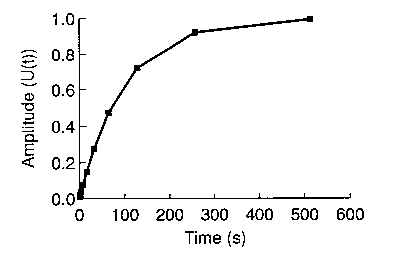
A kapott görbe jellemzői (időállandó, függés hőmérséklettől, pH-tól) ált.
igen hasonlóak a modellpeptideken végzett prolinizomerizációs mérések
eredményeivel
- Natívszerű Pro-izomerizációs intermedierek kimutatására:
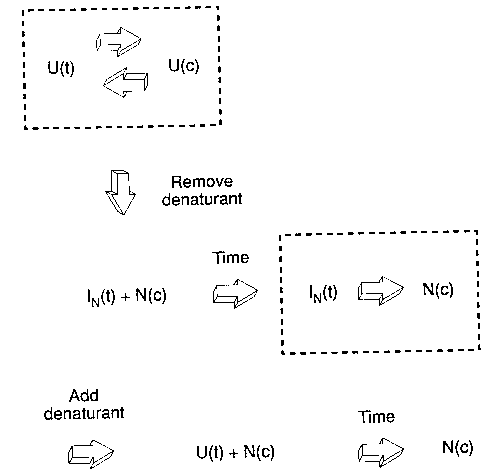
- Denaturált állapotból (izomerek egyensúlya) indulunk ki,
denaturálószerben
- Kihigítással hirtelen eltávolítjuk a denaturálószert (1. ugrás)
- Natív formák (N(c)) és natívszerű izomerek (IN(t))
keletkeznek, utóbbiak lassan átmennek natívba. t
inkubációs ideig hagyjuk zajlani
- Hirtelen hozzáadunk annyi denaturálószert, hogy az instabilabb IN(t)
izomerek (intermedierek) legombolyodjanak, de az N(c) natívak megmaradjanak
(2. ugrás)
- Alternatív megoldás: annyi denaturálószert adunk, hogy a natívak is
legombolyodjanak
- A legombolyodás amplitúdója arányos lesz az inkubációs idő alatt
megmaradt IN(t) mennyiségével
- Ábrázolás: a legombolyodás amplitúdója az inkubációs idő függvényében
- Alternatív megoldásnál: a natív forma más időállandóval gombolyodik
le, így annak az amplitúdója is meghatározható
- Tipikus eredmény:
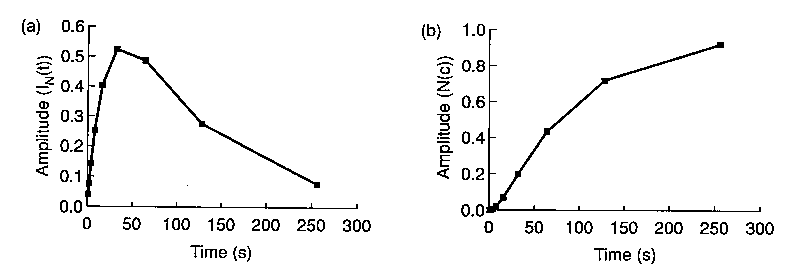
Az intermedier tranziens módon halmozódik fel. Az időállandókat az
intermedier szerkezete befolyásolja (eltérhet a modellpeptideken mérhetőtől)
Izomerspecifikus proteolízis
(Brandts és Lin 1979)
- Számos proteáz izomerspecifikus
- Pl. tripszin: Töltött oldallánc mellett hasít, de csak akkor, ha a
következő kötés transz
- proteolízis sebessége arányos a transz állapot koncentrációjával,
ill. kétfázisú a kinetika, és a lassú fázis amplitúdója a cisz
állapot koncentrációjával arányos
- Pl. RNáz A:
-Lys91-Tyr92-Pro93-
kísérlet szerint: legombolyodott állapotban 33% cisz.
- Nem mindig egyezik más mérési módszerek eredményeivel (pl. NMR), mert a
szerkezet befolyásolja a kötés hozzáférhetőségét.
Mutációs kísérletek
- Több fehérjén: izocitokróm-c, tioredoxin, RNáz T1, RNáz A
- Ált. Pro kicserélése másra eltünteti a felgombolyodás lassú fázisait, de
különféle bonyodalmak léphetnek fel
- élesztő izocitokróm-c:
- Két lassú felgombolyodási fázis: 1. 10 s, 2. 100-200 s
- Két cisz-Pro: 76 és 30
- Pro76 cseréje másra --> 2. lassú fázis eltűnik
- Pro30 cseréje másra: instabil fehérje
- RNáz A:
- 1 gyors és 2 lassú fázis
- Két cisz-Pro: 93 és 114
- Kettős mutáns (mindkét prolin kicserélve): egyfázisú felgombolyodás,
bár lassabb, mint a vad típus gyors fázisa (a fehérje instabilabb)
- Pro114 cseréje: lassú fázisok amplitúdója csökken
- Pro93 cseréje: megmaradnak a lassú fázisok, igen komplex kinetika;
valószínűleg cisz peptidnek kell kialakulnia
Nagyobb fehérjék
- 3-nál több Pro esetében a lassú fázisok dominálnak (akkor is, ha egyik
sem cisz a natív állapotban)
- 20 db Pro esetében az időállandó kb. 600 s
- Minden 10 újabb Pro megtízszerezi az időállandót
A prolinizomerizáció katalízise in vivo
Peptidil-prolil cisz/transz izomerázok
Három család:
- ciklofilinek
- ciklosporin (immunoszupresszáns szer) receptora (immunoszupressziónak
nincs köze a Pro-izomerizációhoz)
- kb. 17 kDa
- aktivitása kevéssé függ a Pro előtti oldallánctól
- FKBP család
- FK506 (szintén immunoszupresszáns szer) binding protein
- riboszómán is előfordul ilyesféle
- 12-13 kDa
- aktivitása erősen függ a Pro előtti oldallánctól
- parvulinok
- Még több típus lehet
- Nem tudjuk, mennyire fontosak in vivo. Élesztőben összeset kiütve semmi
káros hatás.
- Katalízis mechanizmusa: korábban SH-reakcióra gyanakodtak, de ez
megdőlt. Vsz. a szubsztrát szerkezetét eltorzítja
- De novo szintézisben szerepe lehet
- Átstrukturálódásban szerepe lehet, pl. C típusú mannózkötő fehérje
Ca-mentes (inaktív) alakjában a Pro191 transz, az aktivált, Ca-os alakjában
cisz.
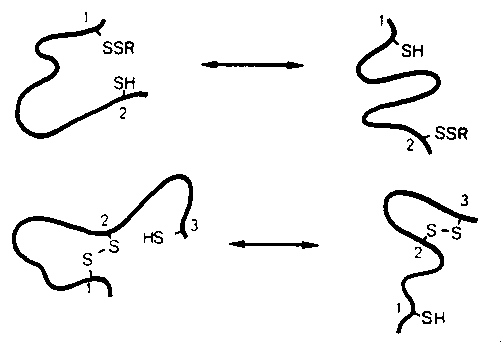
A diszulfidhidak képződése
Miért érdekes?
- Hogyan alakulnak ki a diszulfidhidak a felgombolyodás során?
- A diszulfidhidas intermedierek jól vizsgálhatók, kinetikai szerepük
megbízhatóan azonosítható, a szerkezetről információt ad a diszulfidhidak
elhelyezkedése. Tehát a felgombolyodásról sokat mond.
Felvethető kérdések:
- A diszulfidhidak határozzák meg a szerkezetet vagy a szerkezet a
diszulfidhidakat?
- Vannak-e a felgombolyodás folyamatában nemnatív diszulfidhidak, mi ezek
szerepe?
- Egy vagy több felgombolyodási útvonal van?
- A felgombolyodás sebessége fehérjénként nagyon eltérő. Miért?
- In vivo ugyanúgy történik-e a felgombolyodás, mint in vitro?
- A felgombolyodást katalizáló enzimek (itt: diszulfid izomeráz)
megváltoztatják-e a felgombolyodás mechanizmusát, vagy csak gyorsítják?
Vigyázat! Az eddigi vizsgálatok kis fehérjékkel történtek. Nagy
fehérjékre nem feltétlenül általánosíthatóak.
A diszulfidhidak kémiája
A reakció
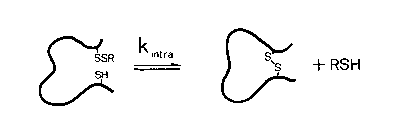
Egyéb intramolekuláris reakciók
- Vegyes diszulfid áthelyeződése a fehérjében
- Diszulfidhíd áthelyeződése a fehérjében (átrendeződés)
A diszulfidhíd kialakulásának valószínűsége
- A szerkezet befolyásolja
- legombolyodott láncban: a két Cys közötti aminosavak számától függ
(m)
- nagy m-eknél m-3/2 -nel arányos.
- Kis m-eknél páros m-re nagyobb, páratlanra kisebb, m=0-ra nagyon kicsi
(cisz peptidkötés kell hozzá)
Diszulfidreagensek
- glutation (gamma-Glu--Cys--Gly tripeptid)
- GSH tiolforma, GSSG diszulfidforma (intermolekuláris)
- in vivo is ez a domináns
- nem változtatja meg a fehérjekonformációt
- egy negatív töltést hordoz (elemzéshez előnyös)
- Ditiotreitol
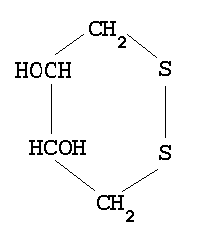
- DTTSHSH tiolforma, DTTSS
diszulfidforma (intramolekuláris)
- lassan oxidál, csak a legkedvezőbb diszulfidhidakat hozza létre
- vegyes diszulfidos termék nem halmozódik fel
- Más-más kinetikai paraméterek nyerhetők a kétféle reagens alkalmazásával
- A fehérje oxidáltsági foka szabályozható a diszulfidreagens
tiol/diszulfid arányának beállításával
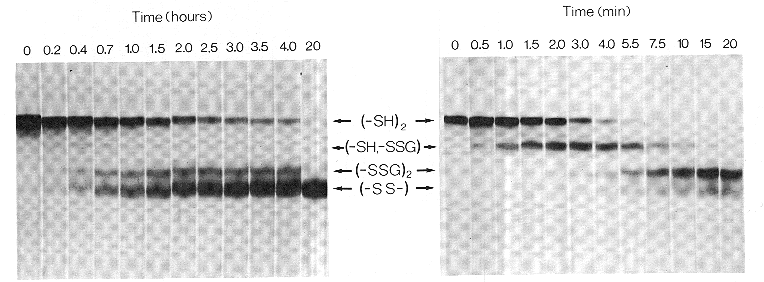
A felgombolyodás elemzése diszulfidhidas
intermedierek révén
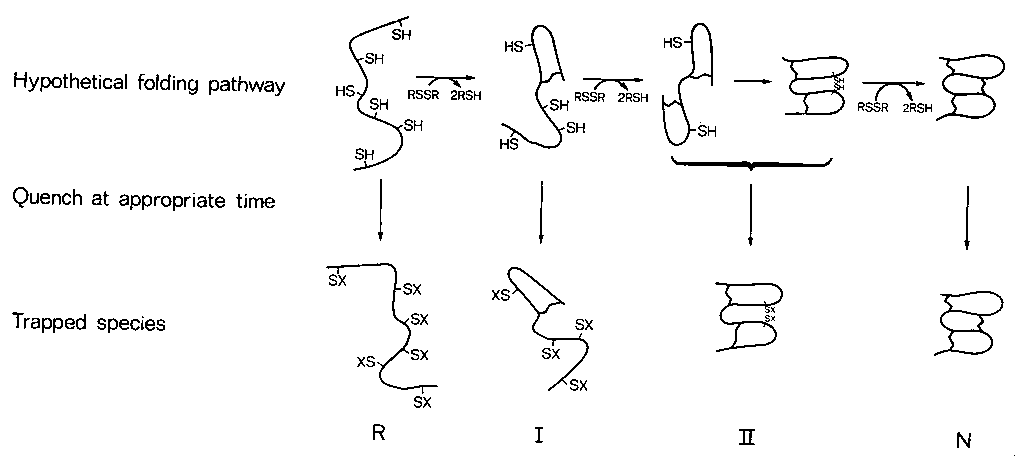
- Teljesen redukált, legombolyodott fehérje felgombolyodását elindítjuk
diszulfidreagensek jelenlétében
- Adott időpontokban leállítjuk ("kioltjuk") a diszulfidhidak képződését
- Az így csapdába ejtett formákat megvizsgáljuk (diszulfidhidak és
konformáció szempontjából)
Az intermedierek csapdába ejtése
A diszulfidhidak képződése megállítható:
- Hirtelen lecsökkentjük a pH-t (pl. 2-re)
- igen gyors, pillanatszerű hatás
- nem áll le a diszulfidok képződése, csak jelentősen lelassul, elemzés
végezhető, de sietni kell
- előnye, hogy megfordítható: újból megemelve a pH-t a folyamat folytatódik
- Alkilálás jódacetáttal vagy jódacetamiddal
- Irreverzibilis, nem kell sietni az elemzéssel
- Lassabb reakció, közben szerkezeti változások történhetnek a fehérjében
- Jódacetát egy negatív töltést visz fel, jódacetamid töltetlen. Ez
elemzéshez előnyös
A csapdába ejtett intermedierek jellemzése
Hány diszulfidhíd van és hol?
Diszulfidhidak révén feltérképezett felgombolyodási
útvonalak
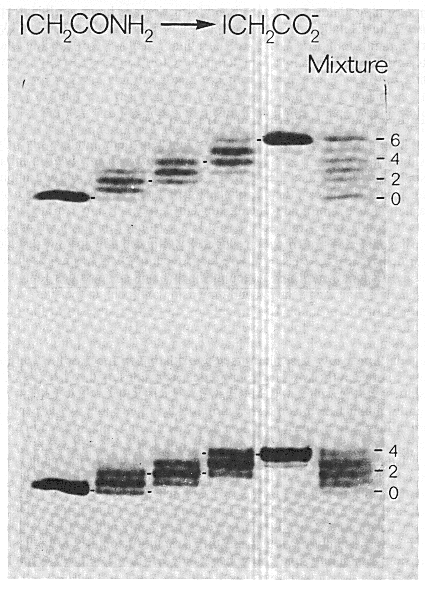
- Csak néhány fehérjére végezték el: BPTI (bovine pancreatic trypsin
inhibitor: marha hasnyálmirigy tripszininhibitor), RNáz A, RNáz T1,
alfa-laktalbumin, stb.
- BPTI
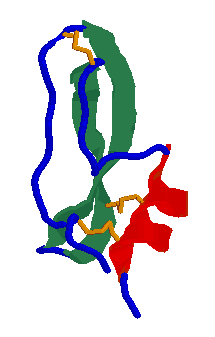
58 aminosav, egy béta lemez és egy hélix. Három diszulfidhíd: 14-38
felszíni, 30-51 és 5-55 eltemetett
- Diszulfidos felgombolyodási kinetika:
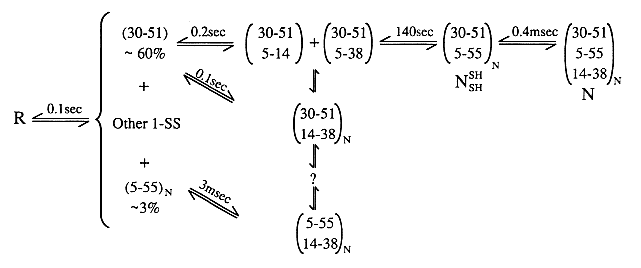
- A redukált BPTI denaturálószer nélkül is csaknem teljesen legombolyodott
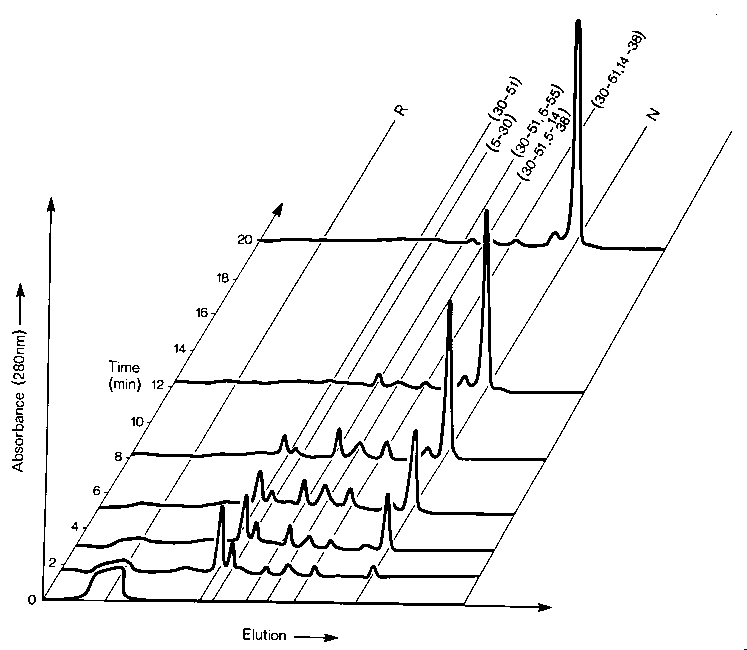
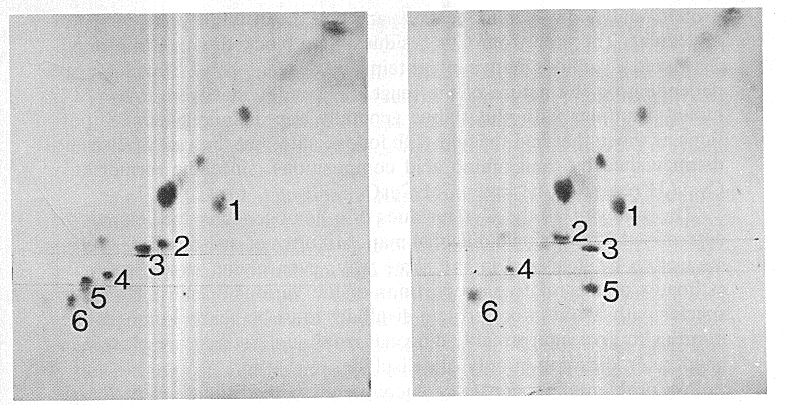
- A felgombolyodás során legalább 8 különböző diszulfidos forma lép fel
(elvben 74 lehetne!)
- Komplex kinetika
- Két nemnatív diszulfidos forma: (30-51,5-14) és (30-51,5-38)
- Egy nagyon lassú szakasz: a (30-51,5-55) kialakulása a nemnatív formákból
- Egy zsákutca: (5-55,14-38)
Szerkezeti háttér (egyéb mérések segítségével)
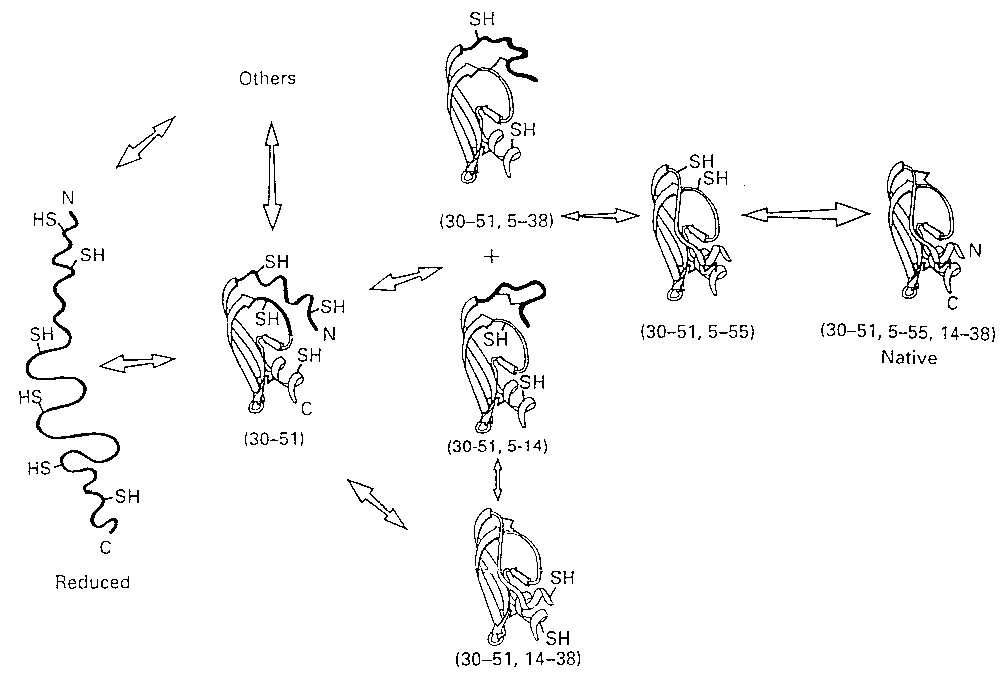
- Legkorábbi szakasz: véletlenszerű diszulfidhidak, a láncban vett
távolságuknak megfelelő valószínűséggel
- A natív szerkezet felé haladás irányítja a diszulfidhidak kialakulását
- Bonyodalmak:
- Kvázinatív szerkezetek
- Kinetikus gátak
- Kvázinatív szerkezet: eltemetődött két Cys, anélkül, hogy köztük
létrejött volna a diszulfidhíd. Itt: (30-51,14-38): az 5 és 55 eltemetődött.
Mivel eltemetődve nem
tud oxidálódni, előbb részlegesen le kell gombolyodnia
- Kinetikus gátak: natív szerkezethez vezető, eltemetett diszulfidhíd létrejötte nehéz, mert a kémiai
reakció az eltemetődéshez és a natív szerkezet kialakulásához csatolt; nagy
az energiagát. Itt: az 5-55 létrejötte a 30-51-es mellett
- A nemnatív formák szerepe?
- Korábban bajnak gondolták, igyekeztek jelentéktelennek minősíteni
- Ma tudjuk: a (30-51,5-14) és (30-51,5-38) formák részlegesen
felgombolyodottak, a nemnatív diszulfidhidak a flexibilis részben jönnek létre
- Szerepük döntő fontosságú: az 5-55 natív diszulfidhíd ezekből jön létre
átrendeződéssel!
A kinetikus intermedierek szerepének és fontosságának
meghatározása
- BPTI: Weissman és Kim szerint a (30-51,14-38) intermedier a
legfontosabb, mert nagy mennyiségben halmozódik fel. A két nemnatív
intermedier lényegtelen melléktermék
- Creighton szerint: épp fordítva van! Két szempont:
- A molekulák mekkora része megy át az adott formán?
- Milyen mértékben lassul le a reakció, ha az adott forma nem jöhet létre?
- Kísérleti eredmény: ha a 14-et vagy a 38-at (nem mindkettőt) blokkoljuk
vagy mutáljuk, akkor nem változik meg lényegesen a mechanizmus és az időskála
- A (30-51,14-38) csak azért halmozódik fel, mert stabil kvázinatív
állapotban van, kinetikus csapdába ejtve
- Ezzel szemben a nemnatív formák szerepe döntő, bár kis mennyiségben
jelennek meg
Protein diszulfid izomeráz
- Endoplazmatikus retikulumban (ER) található, ide kerülnek a membrán- és
a szekretált fehérjék (ezekben van diszulfidhíd)
- GSH-GSSG arány itt 1:1 v. 3:1 körüli, oxidálóbb a citoplazmánál
- Tioredoxin doménekből áll, aktív hely: CGHC
- diszulfid-átrendeződéseket katalizál:
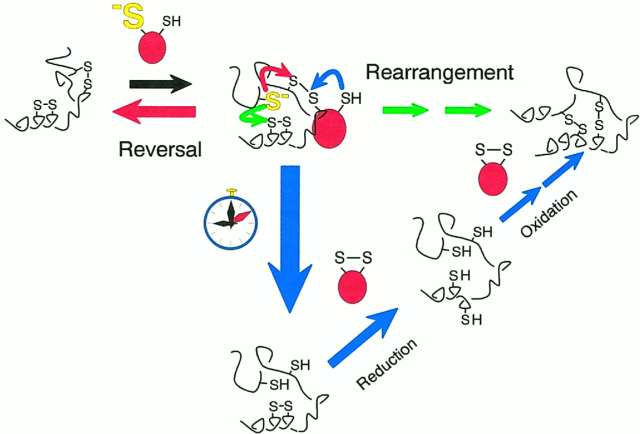
- kovalensen kötődik a fehérjéhez, majd háromféleképpen mehet tovább a
folyamat:
- piros: visszaalakulhat az eredeti diszulfidhíd
- zöld: intramolekuláris átrendeződések: reaktívabb diszulfidok kevésbé
reaktívakkal cserélődnek fel
- kék: a PDI oxidálódva leválik, majd valahol másutt oxidál (egy idő
múlva, ha a másik két útvonal nem megy, ez következik be, így nem maradhat
rajta az enzim a fehérjén)
- Chaperon funkciója is van: aggregációt gátol (lefedve a hidrofób
felszíneket)
- Antichaperon funkció: bizonyos körülmények között (redukáló közeg, kis
koncentráció) aggregációt segít elő (ez in vivo reverzibilis lehet és pl. a
degradációtól való védelmet szolgálhatja)