Több doménből, ill. több alegységből álló fehérjék
összeszerelődése
- A több doménből álló fehérjék felgombolyodása
- Domének
- Izolált domének felgombolyodása
- A doménpárosodás mint sebességmeghatározó lépés
- Versengés a felgombolyodás és az aggregáció között
- A több alegységből álló fehérjék összeszerelődése
- Többalegységes fehérjék
- A több alegység szerepe a funkció szempontjából
- Az alegységek közötti kölcsönhatások
- Az alegység-asszociáció tanulmányozásának módszerei
- Példák többalegységes fehérjék összeszerelődésére
- Versengő mellékreakciók
A több doménből álló fehérjék felgombolyodása
Domének
Többféle definíció:
- Stabil egység (limitált proteolízissel vagy génsebészettel elkülöníthető)
- Termodinamikai egység (kooperatívan gombolyodik le és fel)
- Felgombolyodási egység (függetlenül gombolyodik)
- Szerkezeti egység (látszik a röntgenszerkezetben)
- Genetikai egység (szekvenciaösszehasonlítások alapján jósolható)
- Evolúciós egység (exonoknak felel meg)
- Funkcionális egység (meghatározott részfunkciója van, pl. NAD-kötés)
Izolált domének felgombolyodása
A polipeptidláncot a doménhatároknál szétvágva a domének izolálhatóak,
ill. az egyes domének génsebészeti úton külön-külön előállíthatóak.
Számos izolált doménről mutatták ki, hogy önállóan, reverzibilisen
fel-/legombolyodik
(triptofán szintetáz, béta-laktamáz, aszpartokináz-homoszerin
dehidrogenáz, plazminogén, PGK, stb.)
A domének termodinamikai stabilitása
Speciális esetekben igazolták, hogy a domének a fehérje többi részével
együtt és anélkül is nagyjából azonos stabilitásúak (ez nem feltétlenül
általánosítható)
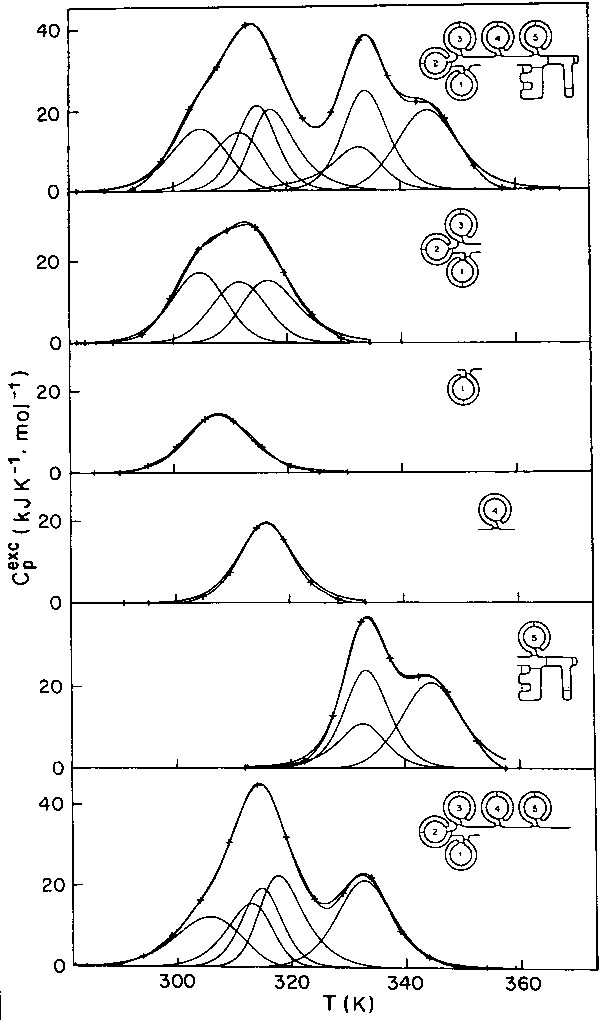
Plazminogén és különféle fragmentumainak kalorimetriás görbéi
A doménpárosodás mint sebességmeghatározó lépés
Számos jel szerint a többdoménes, egyláncú fehérjék felgombolyodásában a
leglassúbb lépés a már felgombolyodott domének párosodása (asszociációja).
Ennek 3 bizonyítéka:
- Az enzimaktivitás csak a felgombolyodás legkésőbbi szakaszában jelenik
meg. Az aktív hely általában a domének érintkezésénél van, az egyes domének
hordozzák az egyes szubsztrátokat.
- A felgombolyodás sebessége fordítottan arányos az oldat viszkozitásával
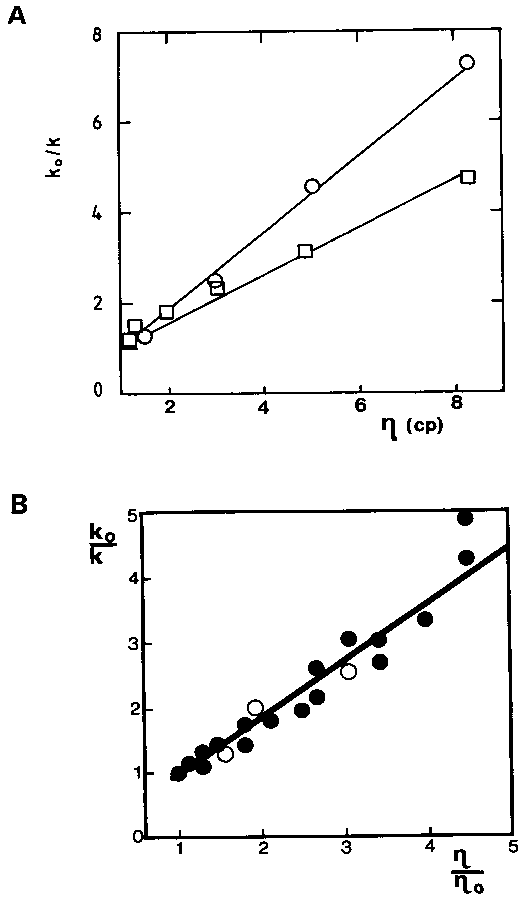
(A: Oktopin dehidrogenáz, B: AK-HDH felgombolyodási sebességének reciproka
a viszkozitás függvényében. Viszkozitásnövelők: glicerin, glükóz,
szukróz
A viszkozitástól való függés nagyméretű egység elmozdulását feltételezi
- Az egyik doménben létrehozott, felgombolyodást lassító mutáció hatása
kompenzálható a másik doménben létrehozott, önmagában szintén lassító
mutációval
Létezik tehát egy állapot, melyben a domének már fel vannak gombolyodva,
de még nem asszociálódtak. Ennek neve: FUD (Folded but Unpaired
Domains): felgombolyodott, de még nem párosodott domének
Általános reakcióséma:
Legombolyodott áll. --(domének gyors felgombolyodása)--> FUD
--(domének lassú párosodása)--> natív
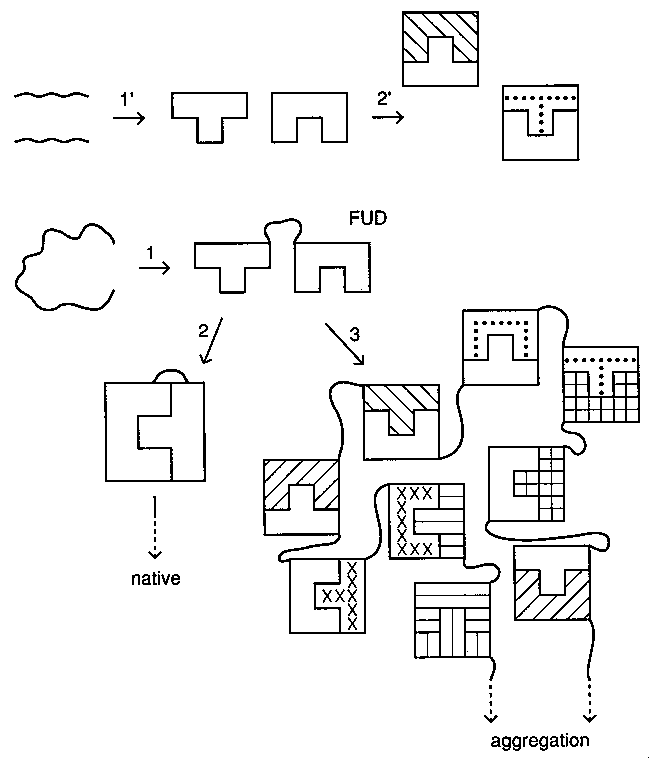
Doménasszociációval járó folyamatok: 1': izolált domének felgombolyodása;
2': izolált domének asszociációja; 1: domének önálló felgombolyodása, FUD
kialakulása; 2: a domének asszociációja, létrejön a natív szerkezet; 3:
párosodás másik molekula doménjével --> aggregáció
Versengés a felgombolyodás és az aggregáció között
- A FUD intermedierben a domének kontaktfelszíne szabad --> más láncok
komplementer felszíneihez is kapcsolódhatnak --> aggregáció!
- Erősen koncentrációfüggő:
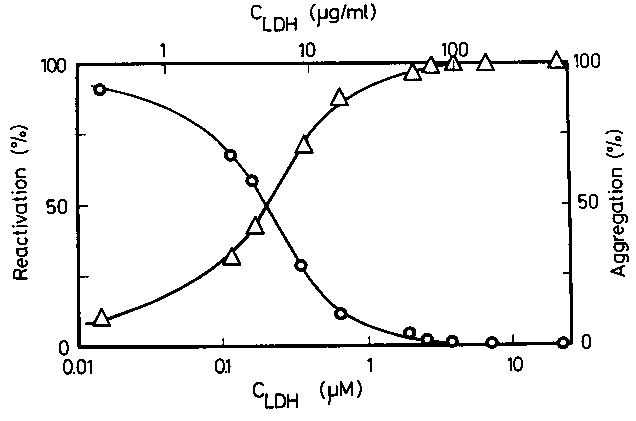
Laktát dehidrogenáz aggregációja (háromszög) és felgombolyodása (kör) a
fehérjekoncentráció függvényében
Az aggregációban valóban a FUD intermedier vesz részt. Ennek bizonyítékai:
- Az aggregáció akkor a legerőteljesebb, ha részlegesen felgombolyodott
molekulák nagy számban vannak jelen
- Az aggregáció specifikus. Más fehérjék jelenléte nem befolyásolja
(még hasonló fehérjéké sem)
- Az aggregáció sokkal kisebb, ha a domének között nincs kovalens
kapcsolat (izolált domének)
A több alegységből álló fehérjék összeszerelődése
Kérdések:
- Mennyiben befolyásolja az alegységek szerkezetét, stabilitását a többi
alegység jelenléte?
- A felgombolyodási folyamat melyik fázisában történik az alegységek
asszociációja?
- Teljesen kész, merev szerkezetű alegységek asszociálódnak, vagy inkább
két olajcsepp egybeolvadásához hasonló az asszociáció? Utóbbi esetben mi
biztosítja a specificitást?
- Egy "olvadt gombóc" jellegű intermedier mutathat-e specificitást?
Többalegységes fehérjék
- Mr=30 000 molekulatömeg alatt többnyire monomer,
Mr=50 000 fölött többnyire oligomer fehérjék
- (Kivételek: pl. izoleucin-tRNS szintetáz (Mr=114 000)
monomer; inzulin (Mr=5700) és MetJ represszor
(Mr=12 000) dimerek)
Néhány negyedleges szerkezet:
| Negyedleges szerkezet | Példa
|
|---|
Homooligomerek
|
| a2 | Kreatin kináz
|
| a3 | Kloramfenikol acetiltranszferáz
|
| a4 | Laktát dehidrogenáz
|
| a6 | Glutamát dehidrogenáz
|
| a8 | Izocitrát dehidrogenáz
|
| a12 | Glutamin szintetáz
|
| a14 | GroEL chaperonin
|
| a24 | Apoferritin
|
Heterooligomerek
|
| ab | Laktóz szintáz
|
| ab5 | Koleratoxin
|
| a2b2 | Triptofán szintáz
|
| a6b6 | Aszpartát karbamoiltranszferáz
|
| a8b8 | Rubisco
|
| abc | Troponin
|
| a4b4c4d4 | Foszforiláz
kináz
|
| a2bb'c | RNS polimeráz
|
| a3b3cde | F1 ATPáz
|
Általában szimmetrikus szerkezetek:
izopropil-malát dehidrogenáz (dimer)
kloramfenikol acetiltranszferáz (trimer)

szérum amiloid P komponens
C-reaktív protein (hexamer)
LHC komplex (light harvesting complex) (nonamer)
TRAP (Trp attenuation protein) (undekamer, 11-mer)

glutamin szintetáz (dodekamer, 12-mer)
A negyedleges szerkezet és az élettani funkció összefüggése:
- Szekretált fehérjék (pl. tripszin, lizozim): ált. kicsi,
egydoménes monomerek, diszulfidhidakkal --> különféle környezetekben
ellenálló
- Vérplazma fehérjéi: nagy monomerek (pl. szérumalbumin 65 kD) vagy
ezek oligomerjei (alfa2-makroglobulin, 4 alegység, 4x180 kD)
--> nem szűrődnek át az erek falán vagy a vesében
- Intracelluláris fehérjék: Ált. több alegység
A több alegység szerepe a funkció szempontjából
- Az aktivitás szabályozása
- Újfajta aktivitások létrehozása
- Nagy szerkezetek képződése
- A felgombolyodott láncok stabilizálása
- Egyéb
Az aktivitás szabályozása
- Az alegységek között pozitív vagy negatív kooperativitás lehet
- Hemoglobin (oxigénkötése)
- foszfofruktokináz
- aszpartát karbamoiltranszferáz
szigmoid alakú függés a szubsztrátkoncentrációtól
- glutamát dehidrogenáz: negatív kooperáció a NAD-kötő helyek között
- Különböző ligandumok közötti kölcsönhatás --> szabályozó funkciók (regulátor molekulák)
- A konformációváltozás ált. kimutatható
Újfajta aktivitások létrehozása
Nagy szerkezetek képződése
- GroEL chaperonin: gyűrű 14 alegységből, közepén lyukkal, mely befogad
egy rosszul felgombolyodott fehérjét
- aktin --> aktinszál
- alfa- és béta-tubulin --> mikrotubulus
- flagellin --> bakteriális ostor
A felgombolyodott láncok stabilizálása
- Az asszociáció növeli az alegységek stabilitását (hidrofób foltokat,
laza hurkokat eltüntet)
- Nehéz mérni a stabilizáció mértékét (disszociáló körülmények az
alegységet is destabilizálják)
- Mérés: Mátrixhoz kötött fehérjéről a szabad alegységet
ledisszociáltatjuk, a megmaradót visszagombolyítjuk, stabilitását mérjük
Egyéb szerepek
- A sejt ozmotikus nyomásának csökkentése
- A hibás felgombolyodás esélye kisebb, ha több, önálló alegységből épül
fel a fehérje, mint ha egyetlen nagy láncból
Az alegységek közötti kölcsönhatások
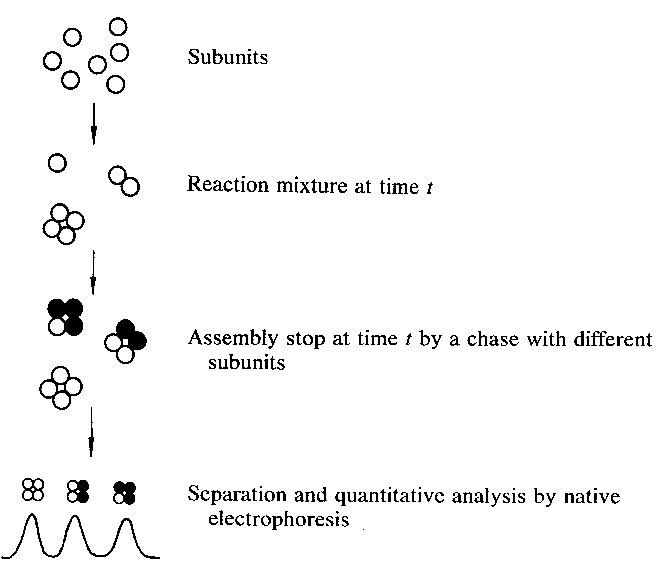
Az alegység-asszociáció tanulmányozásának módszerei
Két megközelítés:
- Olyan körülményeket teremtünk, ahol felgombolyodott, de disszociált
monomerek vannak. Ezután visszaállítva az eredeti paramétereket az
asszociáció elkülönítve vizsgálható. (Ez sokszor nem járható út.)
- Disszociált és legombolyodott monomerekből indulunk ki, együttesen
vizsgáljuk a monomerek felgombolyodását és asszociációját.
Disszociált natív (vagy kvázinatív) alegységek nyerése
- Higítás
Akkor használható, ha nem túl erős az alegységek közötti kapcsolat (pl.
piruvát karboxiláz, foszfofruktokináz)
- Hidegdisszociáció
Hidrofób kölcsönhatás meggyengülése miatt. Pl. élesztő
gliceraldehid-3-foszfát dehidrogenáz (tetramer) 0 Celsius-fokon kvázinatív
monomerekre esik szét (NAD-kötő képesség megmarad)
- Kémiai módosítás
Pl. lizinek töltésének megfordítása dibázikus sav anhidridjével való
módosítással (reverzibilis!). Pl. élesztő zsírsav-szintetáznál
(a6b6) bevált.
- Ligandumindukált disszociáció
Bizonyos speciális esetekben. Pl. glutamát dehidrogenáz (hexamer) GTP
hatására szétesik; cAMP-függő protein kinázról cAMP hatására a katalitikus
egység leválik
- Enyhén denaturáló körülmények (esetleg stabilizálószer egyidejű
alkalmazásával)
- Triptofán szintáz (a2b2) KSCN hatására
- Laktát dehidrogenáz (tetramer) 1M
glicin/H3PO4+EDTA, pH 2,3, plusz 1M
Na2SO4 stabilizáló só hatására
- Laktát dehidrogenáz 2M ureában v. 0,8-1,2M GdmCl-ben dimerekre esik szét
- Glutamát dehidrogenáz (hexamer): 1-1,5M GdmCl-ben két natívszerű
trimerre esik szét, 3M-nél ezek is szétesnek és legombolyodnak
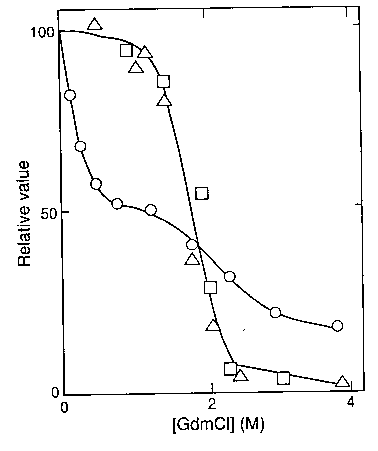
(kör: Mr fényszórással mérve; háromszög, négyzet: másodlagos
és harmadlagos szerkezet CD-vel, ill. fluoreszcenciával mérve)
- Nagy nyomás
>1 kbar nyomás hatására az oligomerek gyakran szétesnek (pl. laktát
dehidrogenáz), mert ezzel csökkenhet a térfogat (oldószer hozzáfér az eddig
eltemetett részekhez)
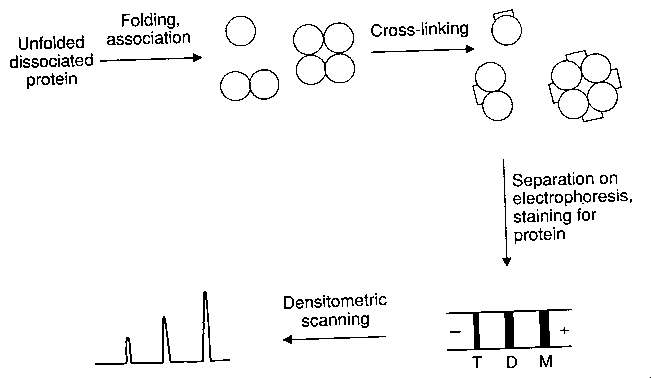
Az asszociáció nyomonkövetése: Biofizikai módszerek fehérje-fehérje
kölcsönhatások mérésére
Az összeszerelődés időbeli nyomon követésének módszerei
Az adatok elemzése
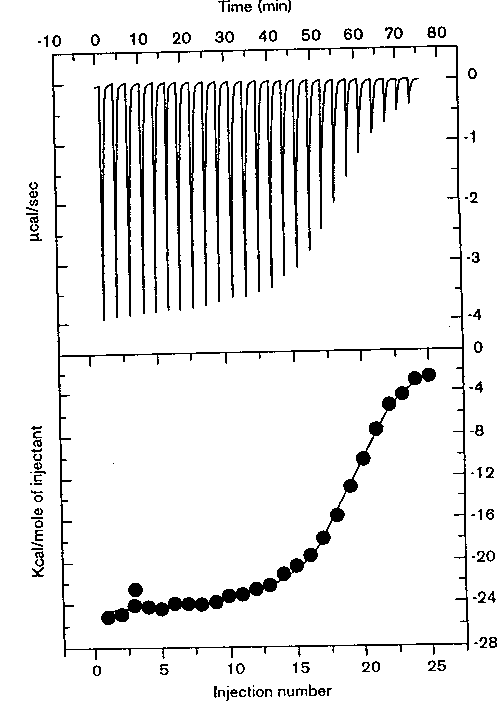
Példák többalegységes fehérjék összeszerelődésére
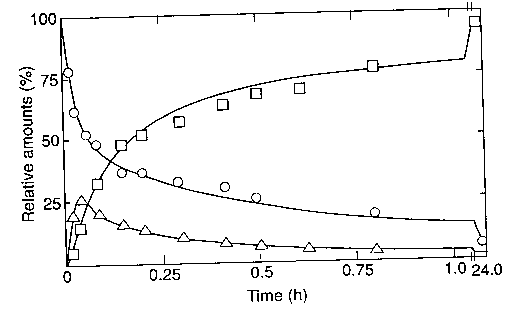
UDP-glükóz dehidrogenáz
Hexamer.
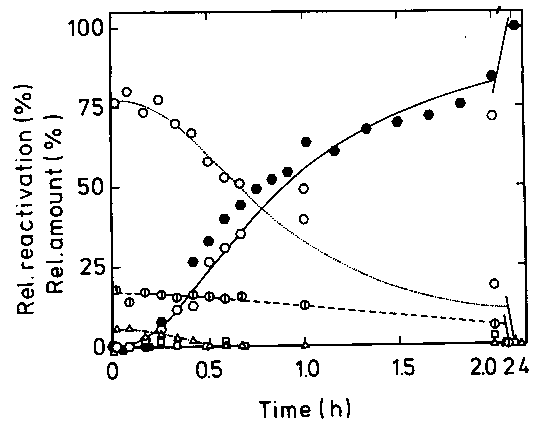
[Keresztkötésből hexamerek (hatszög), tetramerek (négyzet), trimerek
(háromszög), dimerek (félkörök), monomerek (kör) mennyisége. Reaktiváció
(teli hatszög).]
- Trimereket és pentamereket nem lehet megfigyelni
- Az aktivitás visszanyerése a hexamerképződéssel párhuzamos
- Reakcióséma:
6Mu --> 6M --> 3D --> Hexamer
- Az első két lépés sebességi állandói: k1=4,5x10-4
s-1 (elsőrendű) és k2=1,6x104
M-1s-1 (másodrendű)
Aszpartokináz-homoszerin dehidrogenáz (AK-HBH)
(E. coli)
- Tetramer
- Bifunkciós enzim, négy bifunkciós alegység
- Treonin bioszintézisének két korai lépését katalizálja
- Treonin allosztérikusan gátolja
- Mérések:
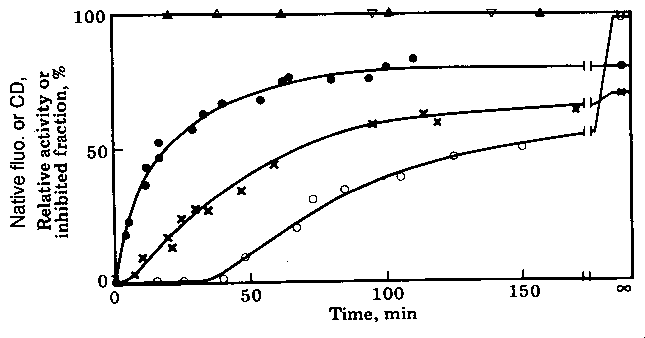
[háromszögek: CD, fluoreszcencia; teli kör: kináz aktivitás, X:
dehidrogenáz aktivitás; üres kör: a kináz aktivitás allosztérikus gátlása
treoninnal]
- Reakcióséma:
4Mu-->4M'-->4M-->2D'-->2D-->T
| | 4Mu | 4M' | 4M | 2D' | 2D | T
|
|---|
| Kináz aktivitás | - | - | + | + | + | +
|
| - gátolhatósága treoninnal | - | - | - | - | - | +
|
| Dehidrogenáz aktivitás | - | - | - | + | + | +
|
| - gátolhatósága treoninnal | - | - | - | - | + | +
|
| Natív fluoreszcencia | - | + | + | + | + | +
|
| Natív távoli UV CD | - | + | + | + | + | +
|
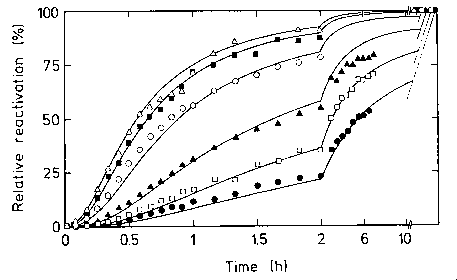
Versengő mellékreakciók
- Alacsony fehérjekoncentrációnál:
- az asszociációs lépések lelassulnak
- a nemasszociált alegységek hosszú ideig fennmaradnak
- csökkent stabilitásuk miatt veszélyeknek vannak kitéve: degradáció
proteázszennyezés által, kémiai módosulás, edény falára tapadás, stb.
- Magas fehérjekoncentrációnál:
Aggregáció következhet be: valamelyik korai intermedier hidrofób felszínei
révén (általában nemspecifikus) asszociáció
Tehát a közepes koncentrációk az ideálisak
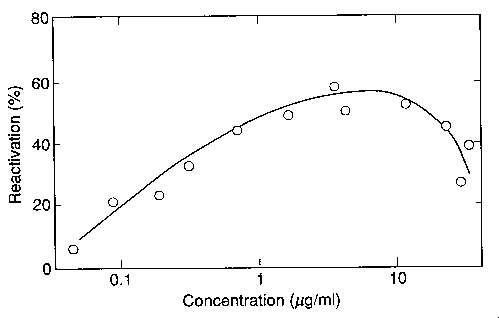
Laktát dehidrogenáz reaktiválhatósága a fehérjekoncentráció
függvényében
(alkalmazások: ld. következő előadás)